某化学课外兴趣小组用下图所示装置探究铜跟浓硫酸的反应情况:
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:__________;
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是__________;
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度。他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是_______(填写编号,仅有一个正确)。
| A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量 |
| B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定装置A产生气体的体积(已折算成标准状况) |
| D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀 |
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析:__________[要求标明不可行的方案序号、说出不可行的理由及造成的误差(偏高或偏低)]。
请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测 定的数据(不必计算)__________。
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如右图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(1)写出A中发生反应的化学方程式。
(2)① 装置B中盛放的试剂为,作用是。
②装置D和E中出现的不同现象说明的问题是。
③写出装置G中发生反应的离子方程式。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在和之间(填两个装置字母序号),装置中应放入
(填写试剂或用品名称)。
(4)丙同学将4.48L氯气(标准状况下测定)通入到足量的石灰乳中,理论上可制得氧化产物质量g。
(14分)室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定该沉淀的组成,某研究性学习小组进行了以下实验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三:。
(二)【理论探究】
假设二中只生成Cu(OH)2的原因是(用一个离子方程式表示)。
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
(三)【实验探究】
步骤一:将CuSO4溶液加入到等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来。
步骤三:利用下图所示装置,选择必要的试剂,定性探究生成物的成分。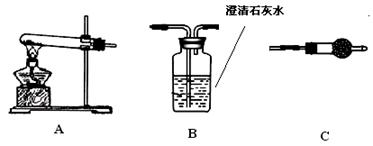
(1)各装置连接顺序为 。
(2)装置C中装有试剂的名称是。
(3)能证明生成物中有CuCO3的实验现象是。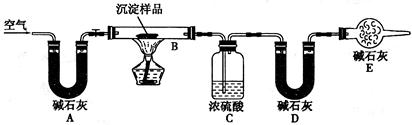
步骤四:步骤三:利用下图所示装置,进行定量分析:
(4)①A装置中玻璃仪器的名称是。
②实验开始时和实验结束时都要通入过量的空气其作用分别是
和。
数据记录:
| B装置中样品的质量(g) |
C装置的质量(g) |
D装置的质量(g) |
|
| 实验前 |
33.3 |
262.1 |
223.8 |
| 试验后 |
24 |
264.8 |
230.4 |
(四)【实验结论】
利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,若所得沉淀是纯净物而不是混合物,通过计算写出该物质的化学式。
研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)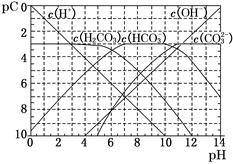
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1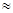 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH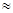 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将。
| A.变大 | B.变小 | C.基本不变 | D.无法判断 |
(2)高温时,用CO还原MgSO4可制备高纯MgO。由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,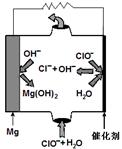
该电池反应的离子方程式为。
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为: CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图
所示,则上述CO2转化为甲醇反应热ΔH0(填“>” “<”或“=”)。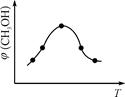
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中各物质浓度相同,且起始时维持反应逆向进行,则c的取值范围为。
过碳酸钠(Na2CO3·3H2O2),有固体双氧水的俗称,被大量应用于洗涤、印染、纺织、造纸、医药卫生等领域中,过碳酸钠的某生产流程如下图所示。已知:2Na2CO3+3H2O2=2Na2CO3·3H2O2 △H<0;回答下列问题:
(1)下列物质可使过碳酸钠较快失效的是(填序号)。
| A.FeCl3溶液 | B.H2S | C.稀硫酸 | D.NaHCO3溶液 |
(2)已知产物C是一种常用氮肥,则其化学式为,
反应①的总反应方程式为。
(3)该生产流程中可循环使用的物质是。
(4)生产过碳酸钠的流程中遗漏了一步,造成所得产品纯度偏低,该步操作的名称是 。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用右图所示装置进行有关实验。
请回答: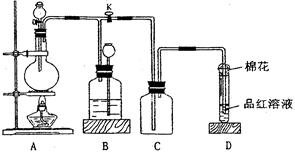
(1) 装置A中发生的化学反应方程式为
_____________________________________。
(2) 装置D中试管口放置的棉花中应浸一种液体,这种液体是 ,其作用是 。
(3) 装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是。
B中应放置的液体是(填字母) 。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4) 实验中,取一定质量的铜片和一定体积18 mol·L—1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
① 有一定量的余酸但未能使铜片完全溶解,你认为原因是。
② 下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填字母)。
a.NaOH固体 b.BaCl2溶液 c.银粉 d.Na2CO3溶液