某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验: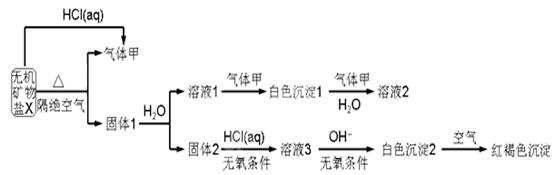
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
氮化铝(AlN0是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+ NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。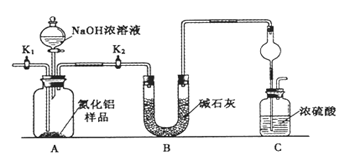
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品,接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。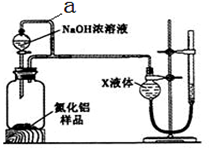
(4)为测定生成气体的体积,量气装置中的X液体可以是 (填选项序号)。
a.CCl4b.C6H6c.NH4Cl溶液d.H2O
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数是 (用含m、V的数学表达式表示)。
【方案3】按以下步骤测定样品中A1N的纯度: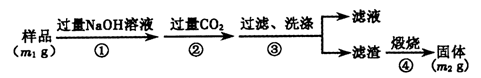
(6)步骤②生成沉淀的离子方程式为 。
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”)。
医疗上绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
Ⅰ.【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备FeSO4•7H2O晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是___________,然后将废铁屑用水洗涤2~3遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2,N2的作用是_____________。
(3)再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为_____________。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,_________________。滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存。
Ⅱ.【测定FeSO4•7H2O含量】
(1)称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、玻璃棒、烧杯、量筒外,还需要的仪器有(填仪器名称)___________________、_________________。
(2)准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是_______________。
(3)用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO4•7H2O的质量分数为_____________。(已知Mr(FeSO4•7H2O)=278)。
(4)若测量结果偏小,则可能是在定容时__________________(填“俯视”或“仰视”)读数。
实验室中需要22.4L(标准状况)SO2气体。化学小组依据化学方程
Zn+2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65g锌粒与质量分数为98%的浓硫酸(密度
ZnSO4+SO2↑+2H2O计算后,取65g锌粒与质量分数为98%的浓硫酸(密度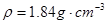 )110mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是 (用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。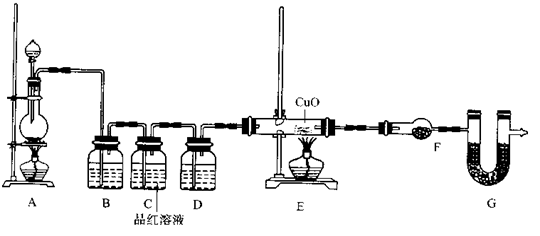
①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。
其生产工艺如下:回答下列问题:
(1)该生产工艺应在_________________(填“温度较高”或“温度较低”)的情况下进行,在溶液I中加入KOH固体的目的是_____________________。
(2)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为________________ _。
(3)高铁酸钾作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
FeO42- + H2O = Fe(OH)3(胶体)+ O2 ↑ + OH-
(4)目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物K2FeO4水溶液稳定性的是(填代号)_________________。
a.亚硫酸钠 b.KOH c.醋酸 d.Fe(NO3)3
(共18分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失快慢的方法,研究影响反应速率的因素。实验条件作如下限定:
所用酸性KMnO4溶液的浓度可选择0.010 mol·L-1、 0.0010mol·L-1, 催化剂的用量可选择0.5 g、0 g,实验温度可选择298 K、323 K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.10mol·L-1)的用量均为2 mL。
(1)已知草酸溶液中各种微粒存在形式的分布曲线图如下,请写出KMnO4酸性溶液与H2C2O4溶液反应的离子方程式 。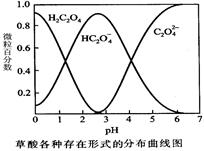
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 |
T/K |
催化剂的用量 / g |
酸性KMnO4溶液的浓度/mol·L-1 |
实验目的 |
| ① |
298 |
0.5 |
0.010 |
a.实验①和②探究酸性KMnO4溶液的浓度对该反应速率的影响; b.实验①和 探究温度对反应速率的影响; c.实验①和 探究催化剂对反应速率的影响。 |
| ② |
||||
| ③ |
0.010 |
|||
| ④ |
(3)某同学对实验①和②分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 |
溶液褪色所需时间 t / min |
||
| 第1次 |
第2次 |
第3次 |
|
| Ⅰ |
14.0 |
13.0 |
11.0 |
| Ⅱ |
6.5 |
6.7 |
6.8 |
① 实验Ⅱ中用KMnO4的浓度变化来表示的平均反应速率为 (忽略混合前后溶液的体积变化)。
②该同学分析上述数据后得出“当其他条件相同的情况下,酸性KMnO4溶液的浓度越小,所需要的时间就越短,亦即其反应速率越快”的结论,你认为是否正确 (填“是”或“否”)。他认为不用经过计算,直接根据表中褪色时间的长短就可以判断浓度大小与反应速率的关系,你认为是否可行 (填“是”或“否”),若不可行(若认为可行则不填),请设计可以直接通过观察褪色时间的长短来判断的改进方案:
(4)该反应的催化剂选择MnCl2还是MnSO4并简述选择的理由:
(5)化学催化剂有很多,在生产和科技领域起到重大作用。探究小组又利用乙装置探究MnO2对H2O2分解的催化效果。将50 mL H2O2一次性加入盛有0.10 mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如下图所示。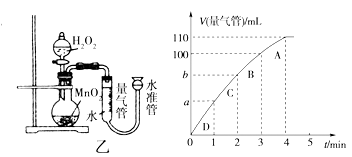
①实验时放出气体的总体积是____ ____mL。
②b______ __(填“大于”“小于”或“等于”)90 mL。