医疗上绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
Ⅰ.【制备产品】
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用如图所示装置制备FeSO4•7H2O晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和Na2CO3溶液中洗涤,目的是___________,然后将废铁屑用水洗涤2~3遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入N2,N2的作用是_____________。
(3)再加入足量稀硫酸,控制温度50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为_____________。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,_________________。滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干,密闭保存。
Ⅱ.【测定FeSO4•7H2O含量】
(1)称取上述样品10.0g,溶于适量的稀硫酸中,配成100mL溶液,需要的仪器除天平、玻璃棒、烧杯、量筒外,还需要的仪器有(填仪器名称)___________________、_________________。
(2)准确量取25mL该液体于锥形瓶中,用0.1000mol/L KMnO4标准溶液滴定,则滴定终点的判断方法是_______________。
(3)用同样的方法滴定3次,平均消耗10.00mL标准液,该样品中FeSO4•7H2O的质量分数为_____________。(已知Mr(FeSO4•7H2O)=278)。
(4)若测量结果偏小,则可能是在定容时__________________(填“俯视”或“仰视”)读数。
(16分).某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: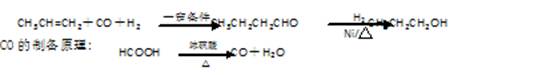
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸,2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:、;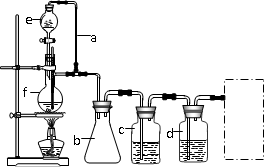
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是、;c和d中盛装的试剂分别是,;若用以上装置制备H2,气体发生装置中必需的玻璃仪器e、f名称是、;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是。(填序号)
①饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3 (饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
试剂1为;操作1为;操作2为;操作3为。
某校化学课外小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的精制、乙醇组成元素的测定、分子式的测定、分子结构的测定。
(1)若所用乙醇中含少量水,采用直接蒸馏的方法不能有效除去水,通常向其中加入,然后蒸馏。证明乙醇不再含水,可用一种试剂检验,这种试剂是。
(2)用燃烧乙醇分析产物的方法确定含有C、H、O三种元素。
a.证明含有H元素的操作是。
b.证明含有O元素时,需取得的实验数据是:CO2的质量,H2O的质量及。
(3)为确定乙醇的分子式,在通过(2)获取乙醇的实验式之后,是否必须再测定乙醇的相对分子质量才能确定其分子式(答“是”或“否”),理由是。
(4)测定乙醇的分子结构
a.若采用红外光谱仪测定,则通过所得红外光谱中有键的振动吸收峰,即可确定乙醇的结构是CH3CH2OH而不是CH3OCH3。(填“C—H”,“C—C”,“C—O”,“O—H”)
b.若采用核磁共振仪测定,则所得乙醇的核磁共振氢谱上应有个吸收峰。
硫酸亚铁铵[ (NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用下所示方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。将处理好的铁屑放入锥形瓶,加入过量的3 mol·L-1H2SO4溶液,加热至充分反应为止。趁热过滤(如图所示),收集滤液和洗涤液。
步骤3:硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过加热浓缩、冷却结晶、过滤、乙醇洗涤后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)步骤1中图13分离方法称为法。
(2)步骤2中有一处明显不合理的是。趁热过滤的理由是。
(3)步骤3加热浓缩过程中,当时停止加热。用无水乙醇洗涤晶体的原因是。
(4)FeSO4·7H2O在潮湿的空气中易被氧化成Fe(OH)SO4·3H2O,写出该反应的化学方程式。
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图9。
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图10所示。
(1)Na2S2O3·5H2O的制备:
步骤1:打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式:。
步骤2:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH时,打开K2、关闭K1并停止加热,理由是。装置B、D的作用是。
步骤3:过滤C中的混合液,将滤液经过、、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向新制氯水中加入Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为①Cr2O72-+ 6I-+ 14H+2Cr3++3I2+7H2O;②I2+ 2S2O32-2I-+ S4O62-。
则该废水中Ba2+的物质的量浓度为。
如图所示3套实验装置,分别回答下列问题。
(1)装置1为铁的吸氧腐蚀实验。一段时间后,溶液略显浅绿色,表明铁被(填“氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为。
(2)装置2中的石墨是极(填“正”或“负”),该装置发生的总反应的离子方程为。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为极;甲烧杯中铁电极的电极反应为。
②乙烧杯中电解反应的离子方程式为。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为mL。