氮化铝(AlN0是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下三种实验方案。(已知:AlN+NaOH+H2O=NaAlO2+ NH3↑)
【方案1】取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
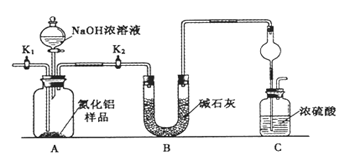
(1)上图C装置中球形干燥管的作用是 。
(2)完成以下实验步骤:组装好实验装置,首先 ,再加入实验药品,接下来的实验操作是 ,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是 。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见 。
【方案2】用下图装置测定m g样品中A1N的纯度(部分夹持装置已略去)。
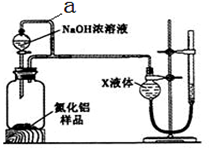
(4)为测定生成气体的体积,量气装置中的X液体可以是 (填选项序号)。
a.CCl4 b.C6H6 c.NH4Cl溶液 d.H2O
(5)若m g样品完全反应,测得生成气体的体积为VmL(已转换为标准状况),则A1N的质量分数是 (用含m、V的数学表达式表示)。
【方案3】按以下步骤测定样品中A1N的纯度:
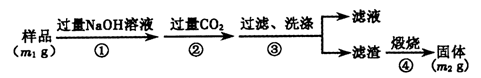
(6)步骤②生成沉淀的离子方程式为 。
(7)若在步骤③中未洗涤,测定结果将 (填“偏高”、“偏低”或“无影响”)。
某工业残渣主要成分为Fe2O3。(含有少量FeO、Cu、Mg等杂质)某课外兴趣小组利用该残渣制取Fe2O3粉末的实验流程如下:(说明流程中向黄色溶液中加入MgO的目的是调节溶液的酸碱性,使Fe3+生成沉淀而Mg2+不沉淀。)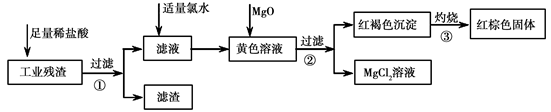
请回答下列问题:
(1)加入足量稀盐酸后,发生化学反应的类型有_____________(填写代号)。
| A.置换反应 |
| B.化合反应 |
| C.分解反应 |
| D.复分解反应 |
E.氧化还原反应
(2)加入适量氯水的作用是 ;
(3)写出灼烧红褐色沉淀时发生反应的化学方程式 。实验室灼烧红褐色沉淀可选用的装置是__________(填序号)。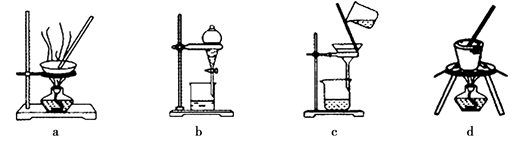
(4)若向黄色溶液中加入过滤①后的滤渣发生反应的离子方程式为 。
(5)检验黄色溶液中Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中, 。(请补充完整实验操作、现象、结论)
通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下: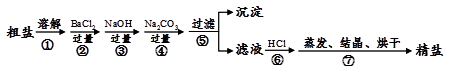
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是 。
(2)第②步操作的目的是除去粗盐中的 (填化学式,下同),第⑥步操作的目的是除去滤液中 。
(3)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、 、 (填化学式)。
(4)判断加入的盐酸“适量”的方法是 。
(5)第③步的化学方程式为__________________________________________
第④步的化学方程式为_______________________、____________________________
下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略)。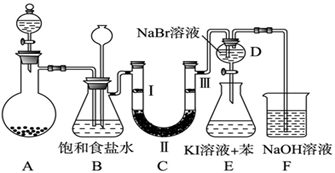
(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关的化学反应方程式为: 。
装置B中饱和食盐水的作用是 ;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入 。
| a |
b |
c |
d |
|
| Ⅰ |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| Ⅱ |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| Ⅲ |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(3)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为 色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是 。
(4)装置F中用足量的NaOH溶液吸收余氯,试写出相应的化学方程式: 。
(13分)根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
(1)验证碳、硅非金属性的相对强弱。(已知酸性:亚硫酸>碳酸)
①连接仪器、 、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是__________________,装置A中的试剂是 。
③能说明碳的非金属性比硅强的实验现象是:_______________________。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是:___________。
②若大量的SO2通入NaOH溶液中,其化学方程式是:__________________。
③BaCl2溶液中无沉淀现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯 水 |
氨 水 |
| 沉淀的化学式 |
写出其中SO2显示还原性并生成沉淀的离子方程式___________________。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2.某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能: ;
(2)实验室用装置E制备Cl2,其反应的化学方程式为:MnO2+4HCl(浓)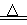 MnCl2+Cl2↑+2H2O。若有0.6 mol的HCl参加反应,则转移的电子总数为 mol;
MnCl2+Cl2↑+2H2O。若有0.6 mol的HCl参加反应,则转移的电子总数为 mol;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ,D: ;
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象是:
B: ,D: ;
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示): 。如果用0.01 mol SO2与0.01 mol Cl2同时非常缓慢地通入100 mL水中,假如得到的溶液体积仍为100 mL,则所得溶液中氢离子的物质的量浓度约为 。