全球海水中溴的蕴藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取方法有:空气吹出纯碱吸收法。该方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:①__________________(写出离子方程式);②Br2+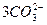 ====
====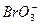 +5Br-+3CO2↑;③
+5Br-+3CO2↑;③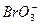 + 5Br-+6H+====3Br2+3H2O。其中反应②中的氧化剂是_________________;还原剂是_________________。
+ 5Br-+6H+====3Br2+3H2O。其中反应②中的氧化剂是_________________;还原剂是_________________。
有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,该化合物具有如下性质:(1)1molX与足量的金属钠反应产生1.5 mol气体;(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物;(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应,根据上述信息,对X的结构判断正确的是
| A.X中肯定有碳碳双键 | B.X中可能有三个羟基和一个一COOR官能团 |
| C.X中可能有三个羧基 | D.X中可能有两个羧基和一个羟基 |
中学化学的常见物质,它们在一定条件下有如下转化关系:
⑴若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。
则A转化为B反应的化学方程式为。
⑵若D是具有氧化性的单质,A元素属于短周期主族金属元素,
则C的电子式为。
⑶若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)。
⑷若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为。
⑸若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为。
⑹若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为。
X、Y、Z、W、R、Q六种短周期元素原子序数依次增大,Y、R、Q三种元素在周期表中相对位置如下: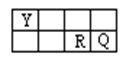
请填写下列空白:
(1)若Y与Q形成的液体化合物是常见的重要有机溶剂。则Y、Q两种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:(用化学式表示以下同)。
(2)若化合物WQ是海水中的主要成分。等浓度的WQ与NH4Cl的混合液,其离子浓度由大到小的顺序为。
(3)若Z、R是同一主族元素且X、Z、R位于不同周期。写出均含X、W、Z、R四种元素的两种化合物相互间发反应生成气体的离子方程式:。
(4)若A是Y元素组成的单质,能发生如右图所示转化,工业上通过在高温下置换反应c制取非金属单质D,C是Z和Y的化合物,B、D在现代信息技术上有着重要用途。则反应c的化学方程式:。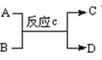
(5)由X、Y两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成水蒸气时所释放的能量为50.125kJ,已知H2O(l) = H2O(g), ΔH =" +44" kJ/mol
请写出表示其燃烧热的热化学方程式:。
已知元素X、Y、Z、W的原子序数分别为6、8、11,请回答:
(1)它们各是什么元素?
(2)不看周期表,你如何来推断它们在周期表中的位置(周期和族)?
截止到1999年,人们已经发现了113种元素,是否可以说我们已经发现了113种原子?为什么?