六价铬对人体有毒,含铬废水要经过化学处理后才能排放。
工业上为处理含有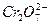 的酸性废水采用如下方法:在工业废水中加入适量NaCl,然后以铁为电极电解,鼓入空气,最后将
的酸性废水采用如下方法:在工业废水中加入适量NaCl,然后以铁为电极电解,鼓入空气,最后将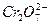 以Cr(OH)3形式沉淀下来而除去,且还生成Fe(OH)3沉淀。这种处理方法可使工业废水中的
以Cr(OH)3形式沉淀下来而除去,且还生成Fe(OH)3沉淀。这种处理方法可使工业废水中的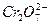 含量达到国家规定的排放标准。试完成下列问题:
含量达到国家规定的排放标准。试完成下列问题:
(1)在工业废水中加入NaCl的作用是:_____________________________________________。
(2)有关电极反应方程式是
________________________________________________________。
(3)由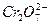 转化为Cr3+的离子方程式是
转化为Cr3+的离子方程式是
___________________________________________。
(4)电解过程中工业废水由酸性变碱性的原因是
______________________________________。
(5)另一种处理含铬废水的方法是用绿矾(FeSO4·7H2O)把废水中的六价铬还原成铬离子,再加入过量石灰水,使铬离子转为氢氧化铬Cr(OH)3沉淀,其主要反应的化学方程式如下:
6H2SO4+H2Cr2O7+6FeSO4====3Fe2(SO4)3+Cr2(SO4)3+7H2O
现用上法处理1×104 L含铬(+6价)78 mg·L1的废水(Cr的相对原子质量52),则:
①处理后沉淀除Cr(OH)3外,还有________________________________(用化学式来表示)。
②需用绿矾多少千克?
㈠已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,则放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比。
(二)在一定条件下,在容积为2L的密闭容器中,将2mol气体M和3mol气体N混合,发生如下反应:2M(g)+ 3N(g) Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
Q(g)+3R(g),经2min达平衡,生成2.4molR,并测得Q的浓度为0.4mol/L。求:
(1)用气体M来表示该反应的化学反应速率是多少?
(2)反应前后的压强比?
(3)N的转化率是多少?
(4)平衡时气体Q所占的体积分数为多少?
请写出计算过程。在标准状况下氢气和一氧化碳的混合气体6.72L,质量为3.2g,求H2和CO的质量和体积。
(1)8.4g N2与9.6g某单质Rx所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是 ,x值为 。
(2)4.5g水与 g硫酸所含的分子数相等,它们所含氧原子数之比是 ,其中氢原子数之比是 。
(3)如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央。则原来H2、O2的体积之比可能为___________。
某气态链烃能使溴水褪色,经测定该烃存在支链,并且0.1mol该烃充分燃烧可以生成7.2g水,请据此回答下列问题:
(1)通过计算确定该烃具有的分子式和结构式。
(2)请对(1)中所确定的烃进行系统命名。
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,相关数据如下表所示。
| 溶质的物质的量浓度/mol·L-1 |
溶质的质量分数 |
溶液的密度/g·cm-3 |
|
| 硫酸 |
c1 |
w1 |
ρ1 |
| 氨水 |
c2 |
w2 |
ρ2 |
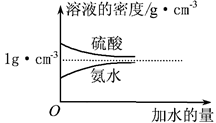
请根据表中信息,回答下列问题:
(1)表中硫酸的质量分数w1为________(不写单位,用含c1、ρ1的代数式表示);
(2)物质的量浓度为c1 mol·L-1,质量分数为w1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1,质量分数_______ w1/2 (填“>”、“<”或“=”);
(3) 质量分数为w2的氨水与w2/5的氨水等质量混合,所得溶液的密度_______ρ2 g·cm-3(填“>”、“<”或“=”);
(4)如果蒸发溶剂使硫酸的的质量分数变为2 w1,则所得硫酸的物质的量浓度 2 c1(填“>”、“<”或“=”)。