有如下三个热化学方程式:
H2(g)+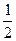 O2(g)====H2O(g)ΔH="a" kJ·mol-1
O2(g)====H2O(g)ΔH="a" kJ·mol-1
H2(g)+ 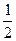 O 2(g)====H2O(l) ΔH="b" kJ·mol-1
O 2(g)====H2O(l) ΔH="b" kJ·mol-1
2H2O(l)====2H2(g)+O2(g)ΔH ="c" kJ·mol-1
关于它们的下列表述,正确的是( )
| A.它们都是吸热反应 |
| B.a、b、c均为负值 |
| C.反应热的关系a="b" |
| D.反应热的关系2b=-c |
化学与生产、生活密切相关。下列说法中,不正确的是( )
| A.“血液透析”利用了胶体的性质 |
| B.服用铬含量超标的药用胶囊会对人体健康造成危害 |
| C.人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 |
| D.绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是( )
| A.硫铁矿煅烧前将要矿粒粉碎,因为大块的硫铁矿不能燃烧 |
| B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应 |
| C.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率 |
| D.SO3用质量分数为98%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全 |
化学工业在经济发展中的作用举足轻重。下列有关工业生产的叙述中,正确的是 ( )
| A.硫酸生产中常采用高压条件来提高SO2的转化率 |
| B.合成氨中采用及时分离液态氨来提高反应速率 |
| C.电解精炼铜中,溶液中c(Cu2+)基本保持不变 |
| D.氯碱工业中阳极得到氢氧化钠和氢气 |
从实验测得不同物质中O—O之间的键长和键能数据(如下表)。其中X、Y的键能数据尚未测定,但可根据规律性推导键能的大小顺序为W>Z>Y>X。该规律性是( )
| O—O键 数据 |
O22- |
O2- |
O2 |
O2+ |
| 键长/10-12m |
149 |
128 |
121 |
112 |
| 键能/kJ·mol-1 |
X |
Y |
Z=494 |
W=628 |
A.电子数越多,键能越大
B.键长越长,键能越小
C.成键所用的电子数越少,键能越大
D.成键时电子对越偏移,键能越大
下列有关元素锗及其化合物的叙述中正确的是( )
| A.锗的第一电离能高于碳而电负性低于碳 |
| B.四氯化锗与四氯化碳分子都是四面体构型 |
| C.二氧化锗与二氧化碳都是非极性的气体化合物 |
| D.锗和碳都存在具有原子晶体结构的单质 |