元素周期表和元素周期律是学习化学的重要工具,可以帮助我们推测元素及其化合物的结构和性质。某元素的原子序数为7,下列有关该元素的推断不正确的是( )
| A.它处于元素周期表中第二周期ⅤA族 |
| B.它的最高正价为+5,负价为-3 |
| C.它的最高价氧化物对应水化物是一种强酸 |
| D.它的非金属性比磷弱 |
. 已知:还原性 ,氧化性
,氧化性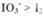 。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法正确的是
。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列说法正确的是
| A.反应过程中的氧化产物均为SO3 |
| B.a点时剩余NaIISO3的物质的量为1.2 mol |
| C.b点时的还原产物可能是KI或NaI |
| D.当溶液中r与I2的物质的量之比为1:1时,加入的KIO3为1.1 mol |
 燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是
燃料电池(DBFC)的结构如右图,有关该电池的说法正确的是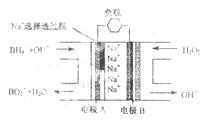
A. 电极B为负极
B. 电池负极区的电极反应为:
C. 放电过程中,Na+从正极区向负极区迁移
D. 在电池反应中,每消耗1 L 6moH.L-1 H2O2溶液,理论上流过电路中的电子为6NA
下列离子方程式不正确的是
A.用惰性电极电解氯化钠溶液: |
B.向FeBr2溶液中通入Cl2,使溶液中一半的Br-被氧化: |
C.用双氧水和稀硫酸处理印刷电路板: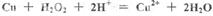 |
| D.向碳酸氢钙溶液中加入足量的氢氧化钠溶液: |

下列说法正确的是
A. 的结构中含有酯基 的结构中含有酯基 |
| B.乙醇、乙酸、乙酸乙酯都可以与NaOH溶液反应 |
| C.1mol葡萄糖可水解生成2 mol乳酸(C3H6O3) |
| D.油脂和蛋白质都是能发生水解反应的高分子化合物 |
下列装置或操 作能达到实验目的的是
作能达到实验目的的是
| A.验证反应的热效应 | B.定量测定化学反应速率 |
| C.滴定FeSO4溶液 | D.构成铜锌原电池 |