今年党中央作出了“西部大开发”的战略决策,在开发的蓝图中有一个“西气东运”的规划,即将西部丰富的天然气资源由管道输送到东部,请用初中学过的化学知识完成下列问题:
(1)天然气的主要成分是(填物质名称)________________。
(2)该主要成分在空气中燃烧的化学方程式是______________________________________。
家庭厨房是一个化学小世界,“柴米油盐”中包含着许多化学知识。
(1)人体需要的营养素主要有糖类、油脂、蛋白质、维生素、矿物质和 。从科学的角度讲,一日三餐应以富含的食物为主食。
(2)绿色植物通过光合作用转化的食品叫绿色食品;海洋提供的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品。根据此分类,花生油属于__________食品。
(3)食物的选择要注意其酸碱性。蛋白质属于 (填“酸性”或“碱性”)食物。这(填“是”或“不是”)因为这类食物在味觉上有酸味。
(4)请写出常用食品防腐剂的化学式或名称 (只写出一种)。
对照试验是化学研究中常用的一种方法。某研究小组对铁生锈进行如下研究。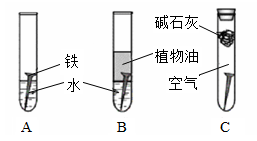
(1)经过较长时间后发现:上述图中的铁钉最容易生锈的是。
(2)在铁钉的锈蚀过程中,Fe发生了(填“氧化”或“还原”)反应。
(3)铁生锈的外部条件是。
(4)钢铁工业史国家工业的基础。下列措施能起到防腐作用的是。
A.刷油漆B.包上一层塑料层C.连接一定数量镁块
现有下列10种物质:
①NaHCO3;②NH4HCO3;③BaSO4;④HF;⑤C2H5OH;⑥Al;⑦食盐水;⑧CH3COOH;⑨HCl; ⑩NaOH。
(1)其中属于非电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟NaOH溶液反应的是_____________。
(2)NaHCO3溶液显性(填“酸”、“碱”或“中”),原因是(结合离子方程式表示)
。
(3)常温时有四种溶液:Ⅰ.pH=4的CH3COOH溶液;Ⅱ.pH=4的HCl溶液;Ⅲ.pH=10的NaOH溶液;Ⅳ.pH=10的CH3COONa溶液。(已知常温时醋酸的电离常数为1.75×10-5)
下列有关叙述正确的是。(忽略溶液混合时的体积变化)
| A.Ⅱ、Ⅲ溶液分别与10g铝粉充分反应,生成H2的量Ⅲ一定更多 |
| B.Ⅰ与Ⅱ等体积混合后,溶液中的c(CH3COO-)为原溶液浓度的1/2 |
| C.将Ⅰ和Ⅲ等体积混合后,溶液pH一定小于7 |
| D.四种溶液各10mL分别加水稀释至100mL后,溶液的pH:Ⅲ>Ⅳ>Ⅰ>Ⅱ |
(4)常温时某HCl溶液中由水电离出的C(H+)=1×10-amol/L,而相同pH的AlCl3溶液中由水电离出的C(H+)=1×10-bmol/L (已知a, b均为小于14的正整数),则a和b之间满足的关系为,(用一个等式和一个不等式表示)。
I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol·L-1 |
1.00×10-3 |
4.50× 10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的ΔH0(填“>”、“<”或“=”)。
(2)前2s内的平均反应速度v (N2)=。
(3)该温度下,反应的平衡常数K=。
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如下图一所示。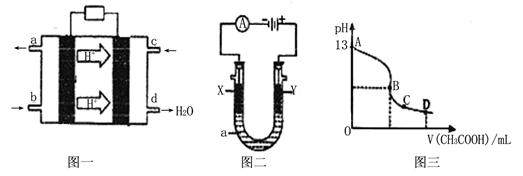
(1)该电池正极的电极反应式为。
(2)以上述电池为电源,构成图二电解池 ,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式。
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸 ) 。
黑火药是中国古代四大发明之一,它的爆炸反应为:
2KNO3+3C+S  K2S+N2↑+3a 已配平
K2S+N2↑+3a 已配平
①画出氮原子的结构示意图 。
②生成物中除氮气与硫化钾外,还有一种物质A生成,则A的化学式为。
③黑火药中位于元素周期表短周期的元素有种;其中一种元素的氧化物可用于漂白纸浆、丝、草帽辫等并能用于杀菌、消毒,该元素在周期表中的位置是,写出该氧化物通入FeCl3溶液反应的离子方程式。
④下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的是。
| A.同条件同浓度溶液的pH:H2CO3>H2SO4 | B.稳定性:H2SO4>H2CO3 |
| C.CS2中碳元素为+4价,硫元素为-2价 | D.溶解性:H2S>CH4 |
⑤已知常温时CuS的Ksp=1.3×10-36,向100 ml 2×10-18 mol/L 的K2S溶液中加入100 ml
2×10-18 mol/L的CuCl2溶液,试通过计算说明有无CuS沉淀生成(写出计算推理过程,忽略溶液混合时的体积变化)。。