β′-Al2O3陶瓷作固体电解质,反应式如下:2Na+xS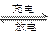 Na2Sx,以下说法正确的是( )
Na2Sx,以下说法正确的是( )
| A.放电时,Na作正极,S极发生还原反应 |
| B.若用此电池电解硝酸银溶液,当阴极上产生标准状况下气体1.12 L时,消耗金属钠2.3 g |
| C.充电时,钠极与外电源的正极相连 |
D.充电时,阳极发生的反应为: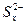  xS+2e- xS+2e- |
下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是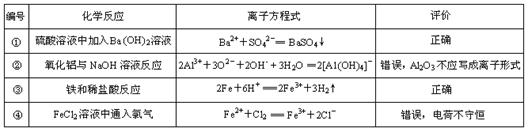
| A.只有② | B.①③ | C.②④ | D.①②③④ |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
13C-NMR(核磁共振)可用于含碳化合物的结构分析,14N-NMR可用于测定蛋白质、核酸等生物大分子的空间结构,下面有关13C、15N叙述正确的是
A.13C与15N具有相同的中子数
B.13C与C60属于同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C 2AlN + 3CO↑
2AlN + 3CO↑
下列叙述不正确的是
| A.在氮化铝的合成反应中,N2是还原剂 |
| B.在氮化铝的合成反应中,C是还原剂 |
| C.氮化铝中氮元素的化合价为-3 |
| D.上述反应中每生成1molAlN,转移3 mol e- |
下列指定微粒的个数比等于2:1的是
A. H原子的中子数和质子数 H原子的中子数和质子数 |
B. Ar原子中的质量数和中子数 Ar原子中的质量数和中子数 |
C. Be2+离子中的电子数和质子数 Be2+离子中的电子数和质子数 |
D. Mg2+离子中的中子数和电子数 Mg2+离子中的中子数和电子数 |