取3份含0.01 mol AgNO3的溶液,分别加入NaCl、MgCl2、FeCl3溶液,恰好完全反应时需要NaCl、MgCl2、FeCl3三种物质的物质的量之比是( )
| A.1∶2∶3 | B.6∶3∶2 | C.3∶2∶1 | D.1∶1∶1 |
某化学活动小组设计如图所示装置(部分夹持装置已略去)实验,以探究潮湿的Cl2与Na2CO3反应的产物。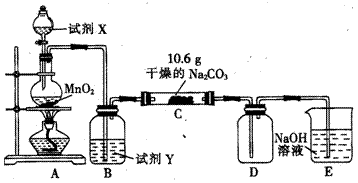
(1)写出装置A中发生反应的化学方程式:__________________________。
(2)写出试剂Y的名称:_______________________________________。
(3)将C中反应后的固体物质分成两等份分装于两支试管中,
①向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,写出产生此现象的离子方程式: ______________;由此现象推断固体产物中含有_____________(填化学式,下同);
②向另一支试管中滴加过量的稀硝酸,有无色无味的气体产生,溶液澄清,再向溶液滴加过量的AgNO3溶液,溶液变浑浊,经过滤、洗涤、干燥,得到7.175g固体,由此现象推断固体产物中含有_____________。
(4)已知C中有0.1molCl2参加反应,D中收集到的气体是氯的一种氧化物。结合(2)中现象及数据可推知,C中反应的化学方程式为__________________________。
D、E为中学化学常见的单质,在一定条件下C、D间能发生反应。各物质转化关系如下图: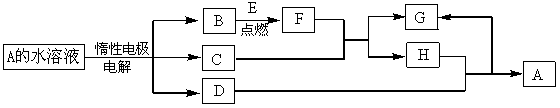
(1)B的同素异形体的名称为:_____________;H的化学式为:_____________。
(2)已知E的燃烧热为QkJ/mol,试写出表示E燃烧热的热化学方程式_____________。
(3)用惰性电极电解A 溶液的阳极反应式为:_____________。
(4)检验H和G的混合溶液中含有G的阳离子的试剂可以是:______ _______。
_______。
a.氯水和KSCN溶液 b.氢氧化钠溶液 c . 酸性KMnO4溶液
. 酸性KMnO4溶液
(5)用惰性电极电解一定浓度的A溶液,通电一段时间后,向所得溶液中加入9.8g含A中金属阳离子的弱碱固体后恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为_____________mol, 收集到标准状况下的气体体积为_____________。
已知:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
2NH3(g)△H=-92.4kJ/mol,这是目前普遍使用的人工固氮的方法。请回答下列问题:
(1)450℃时,往一个2L的密闭容器中充入2. 6mol H2和1mol N2, 反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/mol·L—1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
①5 min内,消耗N2的平均反应速率为_______________,此条件下该反应的化学平衡常数K=_______________;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,此时该反应的v(N2)正_______________v(N2)逆(填写“>”、“=”或“<”=)。
②下列各项能作为判断该反应达到化学平衡状态的依据是__________(填序号字母)
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.v(N2)正=3v(H2)逆 C.容器内压强保持不变
D.混合气体的密度保持不变 E.容器内混合气体的平均分子量不变
③若改变某一条件,达新平衡时n(H2)="1.60mol" ,下列说法正确的是_____________。
A.平衡一定正向移动 B.可能是向容器中加入了一定量的H2气体
C.可能是降低了容器的温度 D.可能是缩小了容器的体积
(2)450℃时,在另一密闭容器中进行上述合成氨的反应,各物质的起始浓度和平衡浓度如下表所示:
| N2 |
H2 |
NH3 |
|
| 起始浓度(mol/L) |
0.2 |
0.3 |
0.2 |
| 平衡浓度(mol/L) |
a |
b |
c |
请回答:
①各物质的平衡浓度可能是_______________.
A.c="0.5mol/L" B.b="0.5mol/L" C.c="0.4mol/L" D.a=0.3mol/L
②a的取值范围是:_______________.
③请用数学表达式表示下列量之间的关系:
(I)a与b的关系:_______________。
(Ⅱ)a、b、c的关系:_______________。
(3) 根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水可发生下列反应:2N2(g)+6H2O(l)  4NH3(g)+3O2(g),此反应的△S__________0(填“
4NH3(g)+3O2(g),此反应的△S__________0(填“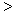 ”、 “
”、 “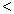 ”或“=”), △H=_____________。
”或“=”), △H=_____________。
(已知:H2的燃烧热为285.8 kJ/mol)
、有一包固体粉末,其中可能含有K2CO3、Na2SO4、BaCl2、、Ba(NO3)2中的一种或几种。现按下列步骤进行实验。
(1)将部分该粉末溶于水,振荡,得无色溶液和白色沉淀
(2)向(1)的悬浊液中加入过量稀硝酸后,白色沉淀溶解,同时产生气泡
根据上述实验现象,可判断原固体粉末的组成可能是(有几种组合写几组):
①___________________________
②___________________________
③___________________________
写出(2)中反应的离子方程式_________________________________________
(3)欲进一步判断固体粉末的组成,可取少量(2)反应后的溶液,滴入_________溶液,如果溶液中_________(填“有”或“没有”)白色沉淀产生,即可得到唯一结论
、(1)如下图横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量,若向硫
酸铝溶液中加入氢氧化钠溶液至过量,沉淀的变化符合A~C中的________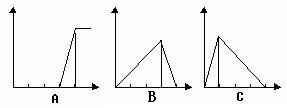
(2)现向1mol/L 100ml的AlCl3溶液中加入一定浓度的NaOH溶液100ml,充分反应后,得到3.9g沉淀,则NaOH溶液的物质的量浓度为________________________