两份质量均为a g的硫,在一定条件下分别跟足量的氢气和氧气完全反应,反应后将生成物混合,析出硫的质量为( )
| A.2a g | B.a g | C.1.5a g | D.0.5a g |
下列关于各实验装置的叙述中不正确的是( ) 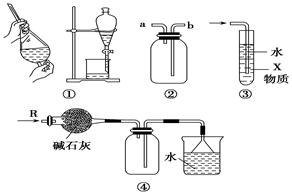
| A.装置①可用于分离C2H5OH和H2O的混合物 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的NH3 |
质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为( )
| A.大于2c mol/L | B.等于2c mol/L |
| C.小于2c mol/L | D.在c mol/L一2c mol/L之间 |
下列实验操作与事故处理错误的是( )
| A.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中 |
B.用试管夹从试管底由下往上夹住离试管口约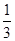 处,手持试管夹长柄末端,进行加热 处,手持试管夹长柄末端,进行加热 |
| C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中 |
| D.把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中 |
某物质A加热分解,产物都是气体,化学方程式为2A B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
B+2C+2D。测得生成的混合气体对氢气的相对密度为d,则A的相对分子质量为( )
A.7d B.5d C.2.5d D.2d
一元中强酸次磷酸(H3PO2)是一种精细化工产品,下列说法正确的是( )
A.次磷酸的电离方程式为H3PO2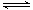 3H++PO23- 3H++PO23- |
| B.次磷酸中P的化合价为+1 |
| C.NaH2PO2是酸式盐 |
| D.NaH2PO2溶液显弱酸性 |