质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为( )
| A.大于2c mol/L | B.等于2c mol/L |
| C.小于2c mol/L | D.在c mol/L一2c mol/L之间 |
仔细观察右图,下列有关说法正确的是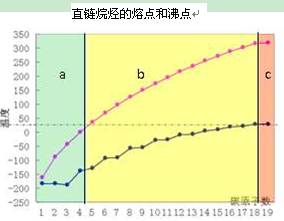
| A.图中b区的直链烷烃在常温下呈液态 |
| B.直链烷烃的熔点随分子中碳原子的增加逐渐升高 |
| C.汽油的化学成份为C5~C12的碳氢化合物,分馏石油时,收集汽油的温度应 控制在200℃以下 |
| D.碳原子数相同的不同烷烃,其沸点都相同 |
设NA为阿伏加德罗常数,下列叙述中不正确的是
| A.1LpH=1的甲酸溶液中,H+数目为0.1 NA |
| B.标准状况下,3.36L乙醇中含有的分子数为0.15 NA |
| C.1 mol甲基(-CH3)所含电子数9NA |
| D.1L 1mol/L的FeCl3溶液所含的Fe3+数目为NA |
表示0.1mol·L-1 NaHCO3溶液中有关微粒浓度的关系式中正确的
| A.C(Na+)>C(HCO3-)>C(CO32-)>C(H+)>C(OH-) |
| B.C(Na+) = C(HCO3-) |
| C.C(Na+)+C(H+) = C(HCO3-)+2C(CO32-)+C(OH-) |
| D.C(Na+) = C(HCO3-)+C(CO32-)+C(H2CO3) |
图1和图2是A、B两种物质的核
磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出不可能属于图1和图2的两种物质是

A.A是C3H6 ;B是C4H6B.A是C2H6 ;B是C3H6
C.A是C2H6;B是C6H6(苯)D.A是C3H6;B是C2H6
有关下列事实中用勒夏特列原理不能解释的是
| A.实验室用排水法收集氯气时用饱和食盐水代替水以减少氯气的溶解 |
| B.氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 |
| C.实验室保存硫酸亚铁溶液时加入几枚铁钉以防止试剂变质 |
| D.在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率 |