如右图所示的是某原子晶体A空间结构中的一个单元,A与某物质B反应生成C,其实质是每个A—A键中插入一个B原子,则C物质的化学式为( )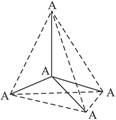
| A.AB | B.A5B4 | C.AB2 | D.A2B5 |
下列叙述中正确的是
| A.硫酸的摩尔质量是98g | B.标准状况下,22.4L的O2质量是32g |
| C.2gH2所含原子数目为1mol | D.铁原子的摩尔质量等于铁的相对原子质量 |
下列实验装置不适用于物质分离的是
某固体NaOH因吸收了空气中的CO2而含有杂质,若要将该固体配制成较纯的溶液,则其主要的实验操作过程应是
| A.溶解→加适量BaCl2溶液→过滤 | B.溶解→加适量CaCl2溶液→过滤 |
| C.溶解→加适量Ca(OH)2溶液→过滤 | D.溶解→加适量盐酸→加热 |
做焰色反应实验用的铂丝,每试验一种样品后都必须
| A.用水洗涤2~3次后再使用 |
| B.用盐酸洗涤后,经蒸馏水冲洗,方可使用 |
| C.用滤纸擦干后才可使用 |
| D.用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用 |
物质的分类是化学研究的重要方法之一。化学工作者经常根据物质的组成对物质进行分类研究。近年来发现,在金星大气层中存在三氧化二碳(C2O3)。下列物质与它属于同类的是
| A.C60、O3 | B.H2O2、N2O4 | C.H2SO4、H2CO3 | D.Na2SO3、KMnO4 |