有X、Y、Z、W、U五种1~20号元素,它们的原子序数依次增大,其中Z和U是金属元素,X和U同族,它们的最外电子层都只有一个电子。Y和W是周期表中相邻的两种元素,它们原子的最外层上的电子数都是X原子电子总数的6倍,Z原子最外层电子数等于W原子最外层电子数的一半。据此完成以下问题:
(1)X元素符号是_____,W离子的结构示意图是__________。
(2)写出Z元素最高价氧化物对应水化物与U和X2Y反应所得溶液作用的离子方程式_______________。
(3)由这五种元素组成的一种化合物的化学式是_______________。
其他条件不变的情况下,下列说法不正确的是:
A. 对于反应nA(g)+B(g)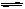 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B. 对于反应2A(g)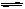 B(g)△H<0,若体系温度不再变化说明反应达到平衡状态。
B(g)△H<0,若体系温度不再变化说明反应达到平衡状态。
C. 对于反应2A(g)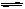 B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
D. 对于反应2A(g)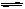 B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是:
2NH3(g)△H=-92.4kJ/mol。N2的平衡转化率(α)与体系总压强(P)的关系如图所示。下列说法正确的是: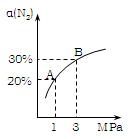
A. 将1.0mol氮气、3.0mol氢气,置于1L密闭容器中发生反应,放出的热量为92.4kJ。
B. 平衡状态由A变到B时,平衡常数K(A) <K(B) 。
C. 上述反应在达到平衡后,增大压强,H2的转化率提高。
D. 升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小。
对于工业制硫酸中接触室内的反应:2SO2(g)+O2 (g)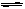 2SO3(g)△H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
2SO3(g)△H<0 。达到平衡时,只改变下列一个条件,平衡不发生移动的是:
| A.升高温度 | B.恒温、恒容充入氧气 |
| C.恒温恒容充入SO3 | D.加入催化剂V2O5 |
中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是:
| A.用溶解度数据判断煮沸Mg(HCO3)2溶液得到的产物是Mg(OH)2而不是MgCO3。 |
| B.用pH数据推测不同强酸弱碱盐在水溶液中水解程度的大小。 |
| C.用反应热数据的大小判断不同反应的反应速率的快慢。 |
| D.用平衡常数的大小判断化学反应可能进行的程度。 |
在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是:
| A.黄铁矿煅烧前需要粉碎,因为大块的黄铁矿不能在空气中反应 |
| B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应 |
| C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 |
| D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率 |