在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是:
| A.黄铁矿煅烧前需要粉碎,因为大块的黄铁矿不能在空气中反应 |
| B.从沸腾炉出来的炉气需净化,因为炉气中二氧化硫会与杂质反应 |
| C.二氧化硫氧化为三氧化硫时需使用催化剂,这样可以提高二氧化硫的转化率 |
| D.三氧化硫用98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高三氧化硫的吸收效率 |
(有机化学基础选做题,共9分)
(1)写出葡萄糖发生银镜反应的化学方程式___________________。
(2)某有机物含C、H、O三种元素,它的红外吸收光谱表明有羟基O-H键和烃基上C-H键的红外吸收峰,且烃基与羟基上氢原子个数之比为2:1,它的相对分子质量为62,则该有机物的结构简式为__________。
(3)向苯酚钠溶液中通入少量的CO2 ,溶液将变浑浊,请写出反应的化学方程式_____________。
(4)某有机物的结构简式如图, 则此有机物可发生的反应类型有______(填字母)
则此有机物可发生的反应类型有______(填字母)
①取代反应②加聚反应③消去反应④酯化反应⑤水解反应⑥氧化反应⑦显色反应
A.①②④⑥⑦B.②③④⑥⑦C.①②③④⑤⑥D.全部
(物质结构与性质选做题,共9分)碳、氮、氧的单质及其化合物在自然界中广泛存在。
(1)基态碳原子的价电子排布图可表示为_____________。
(2)碳、氮、氧原子第一电离能由大到小的顺序是: _________________。
(3)冰晶胞中水分子的空间排列方式与金刚石晶胞类似。每个冰晶胞平均占有________个水分子。
(4)请写出一个反应方程式以表达出反应前碳原子的杂化方式为sp2,反应后变为sp3:__________。
(5)写出CO分子的一种等电子体的分子式__________。
(本题共12分)硫及氯的化合物在生产及生活中有着广泛的应用。
(1)SO2和Cl2均可作漂白剂,但将它们按物质的量1:1通入水中,却没有漂白性,原因是_________(写出反应的离子方程式)。
(2)工业上常用电解法制Cl2,写出反应的化学方程式_______________。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量________(填字母),便能产生沉淀。
| A.氨水 | B.稀盐酸 | C.硝酸钾溶液 | D.氯水 |
(4)将22.4L(标准状况)的SO2气体通入1L1 mol·L-1的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______________。
(5)在25 ℃时,向0.1 L 0.002 mol·L-1的NaCl溶液中逐滴加入0.1 L 0.002 mol·L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中继续加入0.1 L 0.002 mol·L-1的NaI溶液,看到的现象是________,产生该现象的原因是_____________(用离子方程式表示)。(已知:25 ℃时Ksp(AgCl)=1.6×10-10,Ksp(AgI)=1.5×10-16)
海洋资源的利用具有广阔前景。
(1)下列不属于海水淡化的方法___________________(填序号)。
A.蒸馏法 B.离子交换法 C.过滤法 D.电渗析法
(2)下图是从海水中提取镁的简单流程。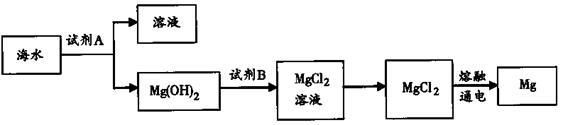
①试剂B是________(填化学式)。
②由无水MgCl2制取Mg的化学方程式是________________________。
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示: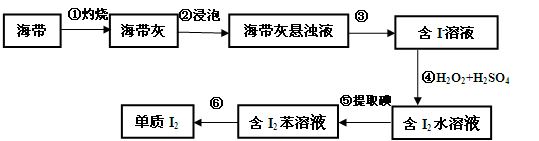
I:下列不属于步骤①操作所用的仪器是 ________(填序号)。
A.酒精灯 B.漏斗C.坩埚 D.泥三角
II:步骤③的实验操作名称是__________。
III:④步骤反应的离子方程式________。
IV:请设计一种检验提取碘后的水溶液中是否含有碘单质的简单方法。
将纯锌片和纯铜片按下图方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题: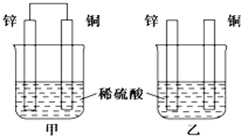
(1)上图两装置中能构成原电池的是(填甲或乙)。
(2)当甲中产生1.12L(标准状况)气体时,理论上通过导线的电子的物质的量为。
(3)现有如下两个反应:A:NaOH+HCl=NaCl+H2O ;B:Fe+2Fe3+= 3Fe2+,根据两反应的本质,判断不能设计成为原电池(填A或B),不能的原因是。