下表是元素周期表的一部分,完成下列有关问题:

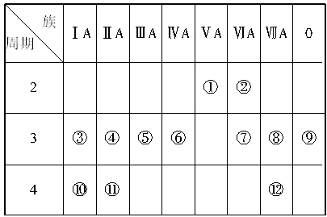
(1)写出下列元素符号:①__________,⑥__________,⑦__________,⑪__________。
(2)在这些元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是_____。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是_____,碱性最强的是_____,呈两性的氢氧化物是_____,写出三者之间相互反应的化学方程式:_______________
(4)在这些元素中,原子半径最小的是_____,原子半径最大的是_____。
(5)在③与④中,化学性质较活泼的是,怎样用化学实验证明?答:__________。在⑧和⑫中,化学性质较活泼的是_____,怎样用化学实验证明?
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型。A、B的最外层电子数之和与C的最外层电子数相等,A以分别与B、C、D形成电子总数相等的分子。
(1)C的元素符号是;元素F在周期表中的位置。
(2)B与D一般情况下可形成两种常见气态化合物,假若现在科学家制出另一种直线型气态化合物B2D2分子,且各原子最外层都满足8电子结构,则B2D2电子式为,其固体时的晶体类型是。
(3)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4气态分子。N4分子结构如图所示,已知断裂1molN—N吸收167KJ的热量,生成1mol C≡C放出942KJ热量。试写出由N4气态分子变成N2气态分子的热化学方程式:。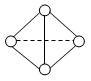
(4)某盐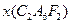 的性质与
的性质与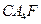 类似,是离子化合物,其水溶液因分步水解而呈弱酸性。
类似,是离子化合物,其水溶液因分步水解而呈弱酸性。
①盐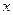 显酸性原因(用离子方程式表示)。
显酸性原因(用离子方程式表示)。
②写出足量金属镁加入盐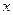 的溶液中产生H2的化学方程式。
的溶液中产生H2的化学方程式。
Ⅰ、已知一个碳原子上连有两个羟基时,易发生下列转化。请根据下图回答问题: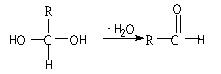
Ⅱ、已知F具有如下特点:①能跟FeCl3溶液发生显色反应;②1mol F最多可消耗2mol NaOH;③F只有一个环且苯环上的一氯代物只有两种。
(1)已知B的相对分子质量为178,其燃烧产物中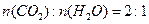 ,则B的分子式是,所有F可能的结构简式为:。
,则B的分子式是,所有F可能的结构简式为:。
(2)写出①的反应方程式:;
写出③的反应方程式:。
(3)若F的同分异构体中,属于酯类的芳香族化合物有种。
(15分)A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分产物省略)。请按要求回答下列问题:
(1) 若A是氯碱工业的一种重要产品,通常状况下D是一种非极性气体分子,则D的结构式为,A与D以物质的量3:2反应后的溶液中离子浓度的大小顺序为:
(2) 若D为某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为;将B的溶液加热蒸干再灼烧,所得固体物质的化学式为。
(3) 若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式为;符合此条件的D物质可能是(填序号)
A.H2SO4 B.CH3COOH C. NaOH D.NH3·H2O E.BaCl2
【有机化学基础】
有机物A-F存在如下图转变关系,元素分析得知,A分子内含一个氧原子,氢的质量分数为7. 41%,其相对分子质量为108;A与FeCl3不发生显色反应,A和乙酸反应可以合成一种有茉莉花香的无色油状液体G,G的纯品用于配制花香香精和皂用香精,G和E互为同分异构体,均为芳香族化合物;E的苯环上只有一个取代基且该取代基碳链上无支链.
请回答下列问题:
(1)写出化合物A的分子式; D的结构简式
(2)指出①、③两步的反应类型:①;③
(3)写出反应②的化学方程式:
(4)写出A的同分异构体(不包括A):
【物质结构与性质】
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2 np2,B元素原子的最外层鬼子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
(1)当n=2时,AB2属于分子(填“极性”或“非极性”),分子中有个δ键、个π键. A6H6分子中A原子的杂化轨道类型是杂化.
(2)当n=3时,A与B形成的晶体属于晶体.
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是(用元素符号表示);A、C、D三种元素的第一电离能由大到小的顺序是(用元素符号表示).
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O.该配合物中的中心离子钴离子
在基态时的核外电子排布式为.作为配位体之一的NH3分子的空间构型为
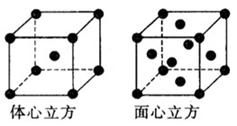
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为