下列有机分子中,所有的原子不可能处于同一平面的是( )
A.CH2==CH—CN B.CH2==CH—CH==CH2
C.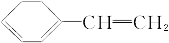
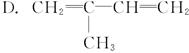
下列能说明甲烷是正四面体而不是平面形分子的是
A.可以与氯气 发生取代反应 发生取代反应 |
| B.二氯甲烷没有同分异构体 |
| C.甲烷的核磁共振氢谱只有一个峰 |
| D.甲烷中的四个碳氢键是等同的,键长均相等 |
有机物 的名称是
的名称是
| A.3-甲基-4-己炔 |
| B.4-乙基-2-戊炔 |
| C.4-甲基-2-己炔 |
| D.2-乙基-3-戊炔 |
下列说法正确的是
| A.天然气的主要成分是乙烷 |
| B.液化石油气的主要成分是CO |
| C.汽油中只含有烷烃 |
| D.天然气是高效清洁燃料 |
下列说法正确的是
| A.钢铁发生电化学腐蚀时,负极发生的反应是:Fe—3e- =Fe3+ |
| B.将钢铁与电源的正极相连,可防止其被腐蚀 |
| C.在镀件上镀铜时可用金属铜作阴极 |
| D.用电解法精炼粗铜时粗铜作阳极 |
欲除去混在苯中的少量苯酚,下列实验方法正确的是
| A.分液 |
| B.加入足量FeCl3溶液,过滤 |
| C.加入过量溴水,过滤 |
| D.加入氢氧化钠溶液后,充分振荡,静置后分液 |