A、B两种烃通常状况下均为气态,它们在相同状况下的密度之比为1∶3.5。若A完全燃烧,生成CO2和H2O的物质的量之比为1∶2,则A的分子式是________,B的分子式是________。
(10分)在一次兴趣小组活动中,一小组同学利用物质间的互变,设计成一平面“魔方”如图所示。已知:
①A、B、C、D、G含有同种元素。
②E是通常情况下密度最小的气体,B与硝酸银溶液反应生
成不溶于稀硝酸的沉淀;B也能将一种能形成酸雨的氧化物氧化
为F,F是一种含氧酸,且F的稀溶液能与A反应生成E和G。
③几种物质的部分物理性质为:
| 物质 |
纯A(单质) |
B(溶液) |
D(固体) |
G(溶液) |
| 颜色 |
银白色 |
黄色 |
红棕色 |
浅绿色 |
依据以上信息填空。
(1)G生成C的过程中所出现的现象为;
(2)写出下列反应化学方程式:A→B:;
(3)写出下列反应的离子方程式:B→F:;
酸性条件下,G与次氯酸溶液反应:;
(4)使一定质量的Zn与100ml18.5mol·L-1酸F的浓溶液充分反应,Zn完全溶解,同时生成标准状况下的气体33.6L。将反应后的溶液稀释至1L,测得溶液中c(H+)="0.1" mol·L-1,则气体的成分及体积比为。
(10分)常温下,如果取0.1mol·L-1的HA溶液与0.1mol·L-1的NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合液的PH=8,试回答以下问题:
(1)混合溶液的PH=8的原因(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)0.1mol·L-1NaOH溶液中由水电离出的c(H+)(填“>”“ <”或“=”)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字)
c(Na+)-c(A-)=mol·L-1,c(OH-)-c(HA)=mol·L-1。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH(填“大于”“小于”或“等于”)7;将同温度下等浓度的四种盐溶液:A、NH4HCO3 B、NH4A C、(NH4)2SO4 D、NH4Cl,按PH由大到小的顺序排列是(填字母)。
硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI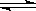 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g)
发生反应Ⅱ,H2物质的量随时间的变化如图所示。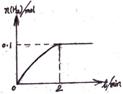
0~2 min内的平均反应速率v(HI)=。
该温度下,H2(g)+I2(g)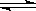 2HI(g)的平衡常数K=。
2HI(g)的平衡常数K=。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡移动(填“向左”“向右”或者“不”);若加入少量下列试剂中的,产生H2的速率将增大。
a.NaNO3b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池。
已知 2H2(g)+O2(g)===2H2O(l)△H=-572KJ.mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为。
科学家一直致力于“人工固氮”的方法研究。
(1)目前合成氨的技术原 理为:
理为: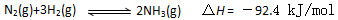
该反应的能量变化如图所示。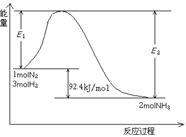
①在反应体系中加入催化剂,反应速率增大,E2的变化是:。(填“增大”、“减小”或“不变”)。
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应: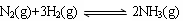
5分钟后达到平衡,测得N2为0.2 mol,H2为0.6 mol,NH3为0.2 mol。氮气的平均反应速率v(N2)=,H2的转化率为,该反应在此温度下的化学平衡常数为。(后两空保留小数点后一位)
③欲提高②容器中H2的转化率,下列措施可行的是。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入惰性气体 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传导H+),从而实现了高转化率的电解法合成氨。其实验装置如图所示。阴极的电极反应式为。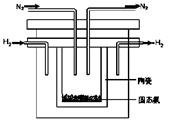
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生下列反应: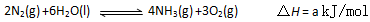
进一步研究NH3生成量与温度关系,常压下达到平衡时测得部分实验数据如下:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
此合成反应的a0。(填“大于”、“小于”或“等于”)
25时,如果取0. 1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的计算结果(填具体数字):
c (HA)+c (A-)=mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶 液:
液:
A.NH4HCO3 B.NH4AC.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列(填序号)