下列各组离子在同一溶液中能够共存的是
A.Ba2+、Cl-、SO 、NO 、NO |
B.Cu2+、K+、Cl-、S2- |
C.K+、H+、SO 、S2- 、S2- |
D.Cu2+、NO 、SO 、SO 、Cl- 、Cl- |
下列有关化学反应速率的说法中,正确的是 ( )
| A.100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 |
| C.二氧化硫的催化氧化是一个放热反应,所以升高温度,反应速率减慢 |
| D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢 |
在一定温度下,向VL密闭容器中充入2molNO2,发生如下反应:2NO2(g)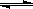 N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是()
N2O4(g)。达平衡后,NO2的转化率为α1。再向容器中充入2 mol NO2,再次达到平衡,NO2的转化率为α2。再向容器中充入1 mol N2O4,再次达到平衡,NO2的转化率为α3 。则α1与α3的关系正确的是()
| A.α1=α3 | B.α1>α3 |
| C.α1<α3 | D.无法确定 |
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为: 2SO2(g)+O2(g) 2SO3(g);△H=-akJ·mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是()
2SO3(g);△H=-akJ·mo1-2在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是()
| A.4 mo1SO2和2mol O2 | B.4mol SO2、2mo1 O2和2mol SO3 |
| C.4mol SO2.和4 mo1 O2 | D.6mo1 SO2和4 mo1 O2 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g) 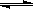 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是 ( )
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论不正确的是( )
A.容器中发生的反应可表示为:3X(g)+Y(g) 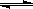 2Z(g) 2Z(g) |
| B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L·min) |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K增大 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |