(9分)分别设计化学实验,用最佳方法证明明矾溶于水时发生的下列变化:
供选用的药品和仪器:明矾溶液、甲基橙试液、酚酞试液、pH试纸、NaOH溶液、酒精灯、半透膜、电泳仪、聚光束仪等。
(1)证明明矾发生了水解反应: 。
(2)证明其水解反应是一个吸热反应: 。
(3)证明生成了胶体: 。
(10分)垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃的含铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。实验方案如下: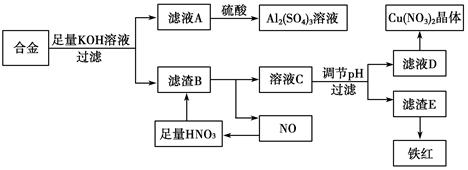
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:__________________。
(2)已知Fe(OH)3沉淀的pH是3~4,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中可用作调整溶液C的pH的试剂是________(填序号)。
| A.铜粉 | B.氨水 | C.氢氧化铜 | D.碳酸铜 |
(3)常温,若溶液C中金属离子均为1 mol·L-1,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20。控制pH=4,溶液中c(Fe3+)=____________,此时________Cu(OH)2沉淀生成(填“有”或“无”)。
(4)将20 mL Al2(SO4)3溶液与等物质的量浓度的Ba(OH)2溶液80 mL混合,反应的离子方程式为_______________。
(10分)如下图所示装置可用来制取和观察Fe(OH)2在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。填写下列空白。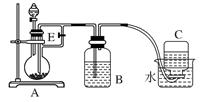
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是____________,A中反应的离子方程式是:_________。
(2)实验开始时就先将活塞E______(填“打开”或“关闭”),C中收集到气体的主要成分是________。
(3)简述生成Fe(OH)2的操作过程________________。
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式:__________。
某学生利用下图实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。按照实验步骤依次回答下列问题:
(1)导线中电子流向为____________(用a、b表示)。
(2)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________ (用“NA”表示);
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是________。
| A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动 |
| B.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动 |
| C.盐桥中的K+、Cl-都向左侧烧杯移动 |
| D.盐桥中的K+、Cl-几乎都不移动 |
(4)若将反应2Fe3++Cu===Cu2++2Fe2+设计成原电池,写出电极反应式。
正极反应______________;
(5)下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式。
①电池总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag:__________。
②2C2H2+5O2 4CO2+2H2O:_________________。
4CO2+2H2O:_________________。
③6H2O+6CO2 C6H12O6(葡萄糖)+6O2:__________。
C6H12O6(葡萄糖)+6O2:__________。
(除第4小题3分外,其它每空2分,共13分)硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案
方案一 滴定法:用酸性KMnO4溶液滴定测定铁元素的含量
反应原理:5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需________(填仪器名称)。
(2)上述实验中KMnO4溶液需要酸化,用于酸化的酸是________。
| A.浓盐酸 | B.稀硫酸 | C.稀硝酸 | D.浓硫酸 |
(3)某同学设计的下列滴定方式中,最合理的是________(夹持部分略去)(填字母序号)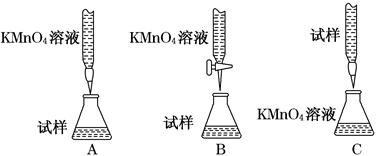
方案二 称量法 操作流程如下: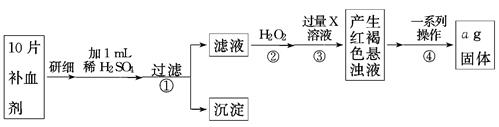
(4)写出步骤②中H2O2氧化Fe2+的离子方程式______ __。
(5)步骤③中X溶液是 。
(6)步骤④一系列操作依次是:过滤、洗涤、______、冷却、称量。
(1~5小题每空2分,6小题3分,共17分)以下是实验室常用的部分仪器,请回答下列问题
(1)序号为⑥和⑩的仪器的名称分别为________、________。
(2)在过滤操作中,必须用到上述仪器中的___(填序号),次外,上图中还缺少的玻璃仪器 (填名称)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)仪器上标有温度的是_______(填序号)。
(5)如图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是
| A.①是量筒,读数为2.5 mL |
| B.②是量筒,读数为2.5 mL |
| C.③是滴定管,读数为2.5 mL |
| D.②是温度计,读数是2.5 ℃ |
(6)丙同学想用如图装置以大理石和稀盐酸反应制取CO2。教师指出,这需要太多的稀盐酸,造成浪费。该同学选用了上述①~⑩中的一种仪器,加在装置上,解决了这个问题。请你把该仪器画在图中合适的位置。