氰化物多数易溶于水,有剧毒,易造成水污染。为了增加对氰化物的了解,同学们查找资料进行学习和探究。
探究一:测定含氰水样中处理百分率
为了测定含氰水样中处理百分率,同学们利用下图所示装置进行实验。将CN-的浓度为0.2000 mol/L的含氰废水100 mL与100 mL NaClO溶液(过量)置于装置②锥形瓶中充分反应。打开分液漏斗活塞,滴入100 mL稀H2SO4,关闭活塞。
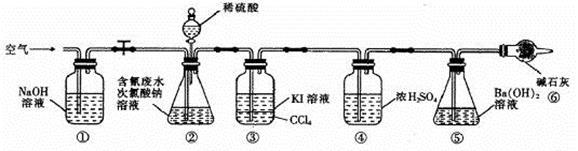
已知装置②中发生的主要反应依次为:
CN-+ ClO-=CNO-+ Cl- 2CNO-+2H+ + 3C1O-=N2↑+2CO2↑+ 3C1-+H2O
(1)①和⑥的作用是 ;
(2)反应结束后,缓缓通入空气的目的是 ;
(3)为了计算该实验装置②锥形瓶中含氰废水被处理的百分率,实验中需要测定装置 反应前后的质量(从装置①到⑥中选择,填装置序号)。
探究二:探究氰化物的性质
已知部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离平衡常数 ( 25℃) |
Ki=1.77×10-4 |
Ki=5.0×10-10 |
Ki1=4.3×10-7 Ki2=5.6×10-11 |
(4)NaCN溶液呈碱性的原因是 (用离子方程式表示)
(5)下列选项错误的是__________
A.2CN-+H2O+CO2=2HCN+CO32-
B.2HCOOH+CO32-=2HCOO-+H2O+CO2↑
C.中和等体积、等浓度的NaOH消耗等pH的HCOOH和HCN溶液的体积前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
(6)H2O2有“绿色氧化剂”的美称;也可消除水中的氰化物(如KCN),经以下反应实现:
KCN+H2O2+H2O=A+NH3↑,则生成物A的化学式为 。
(7)处理含CN-废水时,如用NaOH溶液调节pH至9时,此时c(CN-) c(HCN)(填“>”、“<”或“=”)
要除去下表所列有机物中的杂质(括号内为杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择分离提纯的方法,用序号填入表中。
(1)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
(2)方法:A.过滤 B.分液 C.蒸馏
| 要提纯的物质 (杂质) |
溴乙烷 (乙醇) |
乙醇 (水) |
乙醇 (乙酸) |
溴苯 (溴) |
苯 (苯酚) |
| (1)选用试剂 |
|||||
| (2)分离方法 |
(3)以上采用的操作中,B使用的主要玻璃仪器是____________________________。
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):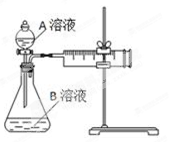
| 实验序号 |
A溶液 |
B溶液 |
| ① |
20 mL 0.1 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
| ② |
20 mL 0.2 mol·L-1H2C2O4溶液 |
30 mL 0.01 mol·L-1KMnO4溶液 |
(1) 该实验探究的是因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是①②(填“>”、“<”或“=”)。
(2) 若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL)
(3) 除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定来比较化学反应速率。
(4) 小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是: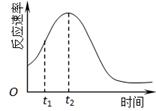
①产物Mn2+是反应的催化剂、②。
(12分)某研究小组为了探究“铁与水蒸气”的反应的产物,进行了下列实验:用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒高温下不与水和铁反应).
(1)如何检查该装置的气密性:
(2)写出铁与水蒸气反应的化学方程式
(3)验证固体产物中铁元素的价态
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;1mol/L CuSO4、3mol/L H2SO4、3mol/L HNO3、30%H2O2、0.01mol/L KMnO4、20%KSCN、蒸馏水。
| 实验步骤 |
预期现象与结论 |
|
| 步骤1 |
取反应后干燥的固体ag于试管中,加入足量的1mol/L CuSO4溶液,充分振荡,经固液分离、洗涤后,再向固体中滴加足量的,振荡溶解,过滤后将滤液配成250mL溶液,待用。 |
|
| 步骤2 |
取少量步骤1中滤液于试管中, |
|
| 步骤3 |
取少量步骤1中滤液于试管中, |
步骤1中加入足量1mol/L CuSO4溶液的作用是。
.苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白: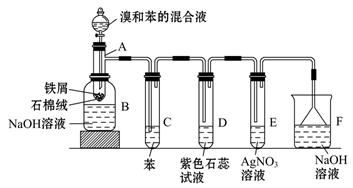
(1)试管C中苯的作用是:_____________________________________。
反应开始后,观察D和E两试管,看到的现象为: D ______________; E__________________________。
(2)反应2~3 min后,在B中的NaOH溶液里可观察到的现象是________________________________。
(3)在上述整套装置中,具有防倒吸的仪器有______________________________(填字母)。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1) MgCO3的分解产物为。
(2) 装置C的作用是,处理尾气的方法为。
(3) 将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯给装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
已知:3Fe2+ + 2[Fe(CN)6]3- = Fe3[Fe(CN)6]2↓(蓝色)
① 乙组得到的黑色粉末是;
② 甲组步骤1中反应的离子方程式为;
③ 乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为
;
④ 从实验安全考虑,上图装置还可采取的改进措施是;