信息时代产生的大量电子垃圾对环境构成了极大的威胁。某化学兴趣小组将一批废弃的线路板简单处理后,得到主要含Cu、Al及少量Fc、Au、Pt等金属的混合物,设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表
| 沉淀物 |
Fe( OH)2 |
Fe( OH)3 |
Al( OH)3 |
Cu( OH)2 |
| 开始沉淀 |
5.8 |
1.1 |
4.0 |
5.4 |
| 完全沉淀 |
8.8 |
3.2 |
5.2 |
6.7 |
请回答下列问题:
(1)第①步操作前需将金属混合物进行粉碎,其目的是 ;
(2)某学生认为用H2O2代替浓HNO3更好,理由是 ;
请写出Cu溶于H2O2与稀硫酸混合溶液的离子方程式是 。
(3)第②步中应将溶液pH调至 。
(4)由滤渣2制取Al2( SO4)3.18H2O,探究小组设计了两种方案:
你认为 种方案为最佳方案,理由是 、 。
(5)为了测定硫酸铜晶体的纯度,某同学准确称取4.0g样品溶于水配成l00mL溶液,取l0m溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.l000mol·L-1Na2S2O3标准溶液滴定至终点,共消耗14. 00mL Na2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2+ +4I-=2CuI(白色)↓+I2 2S2O +I2= 2I-+S4O
+I2= 2I-+S4O
①样品中硫酸铜晶体的质量分数为____ 。
②另一位同学提出通过测定样品中硫酸根离子的量也可求得硫酸铜晶体的纯度,其他同学认为此方案不可行,理由是 。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题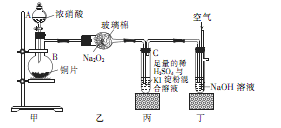
(1)装置甲中盛放浓硝酸的仪器A的名称是,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为。反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol·L—1HCl、1mol·L—1H2SO4、1mol·L—1BaCl2、1mol·L—1Ba(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。
氢化钙(CaH2)固体是登山运动员常用的能源提供剂。氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气。氢化钙通常用氢气与金属钙加热制取,图1是模拟制取装置:
(1)装置B的作用是;装置D的作用是;
(2)利用图1实验装置进行实验,实验步骤如下:检查装置气密性后装入药品;打开分液漏斗活塞,(请按正确的顺序填入下列步骤的序号)。
①加热反应一段时间②收集气体并检验其纯度
③关闭分液漏斗活塞④停止加热,充分冷却
(3)为了确认进入装置C的氢气已经干燥,应在B、C之间再接一装置,该装置中加入的试剂是:。
(4)甲同学设计一个实验,测定上述实验中得到的氢化钙的纯度(杂质中不含钙元素。请完善下列实验步骤:
①样品称量;②加入________溶液(填化学式),搅拌、过滤;③________(填操作名称);④_______(填操作名称); ⑤称量碳酸钙。
(5)乙同学利用注射器测量氢化钙和水反应氢气体积的方法,测定上述实验中得到的氢化钙的纯度。他称取46 mg 所制得的氢化钙样品,记录开始时注射器活栓停留在10.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定)。试通过计算求样品中氢化钙的纯度:。
(6)请你再设计一种氢化钙纯度的测定方法:。
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)若某种固体物质受热发生了分解,下列说法正确的是()
A.充分加热后一定有固体残留 B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化 D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体,则Na2SO3固体加热到600℃以上分解的化学方程式。如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3—的物质的量浓度变化趋势为;
(3)如果加热温度高于600℃一段时间后,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为;此时在B、C两装置中可能观察到得现象为。
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,以下是检验阴离子(X)的两种实验方案,你认为合理的方案是(填“甲”或“乙”),请说明另一方案不合理的原因 。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
查找资料发现,N2制取有下列不同方案:
a方案:加热条件下NH3还原CuO制得纯净的N2和活性铜粉
b方案:加热NaNO2和NH4Cl的浓溶液制得
c方案:将空气缓慢地通过灼热的铜粉制得较纯的N2
现在实验室有供选择的如下几种仪器来制取N2
(1)若按 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
(2)写出b方案中反应的化学方程式_________________________
(3)若按 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________
(4)上述制N2的三个方案中, 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。
研究氧化还应常用到高锰酸钾,高锰酸钾是一种重要的化学试剂。为了增强其氧化性常将其酸化,但在酸性条件下其水溶液不很稳定,会分解生成二氧化锰和氧气,而在中性或弱碱性溶液中分解速度很慢,见光分解速度加快。
(1)高锰酸钾溶液保存的注意事项______________________________________________。
酸性溶液中高锰酸钾分解的离子方程式 _______________________________________。
(2)草酸可使酸性高锰酸钾溶掖褪色,请写出此反应的离子方程式______________________。
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如下表:
| 滴入 KMnO4认溶液的次序(每滴溶液等体积) |
KMnO4溶液紫色褪去的时间 |
| 先滴入第 1 滴 |
1min |
| 褪色后再滴入第 2 滴 |
15s |
| 褪色后再滴入第 3 滴 |
3s |
| 褪色后再滴入第 4 滴 |
1s |
请分析高锰酸钾溶液褪色时间变化的原因________________________________________。
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠来标定高锰酸钾济液的浓度。他们准确称取2.680g纯净的草酸钠配成500mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定。
①高锰酸钾溶液应装在______(填下途中的仪器编号)。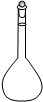



甲乙丙丁
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定开始时,操作上必须是______________。
③当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为________________。
(附原子相对质量K=39Mn=55O=16Na=23C=12)