以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚 再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥ 根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2)指出实验步骤中存在的错误并改正: ;
(3)硫酸钠不能放置在空气中冷却的原因是 ;
(4)步骤⑤的目的是 ;
(5)下面的情况有可能造成测试结果偏高的是 (填序号)。
| A.试样中含有加热不挥发的杂质 | B.试样中含有加热易挥发的杂质 |
| C.测试前试样已有部分脱水 | D.实验前坩埚未完全干燥 |
E.晶体加热脱水不完全 F.加热时有晶体溅出
草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
称取Wg草酸晶体,配成100.00mL无色水溶液。量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol·L-1的KMnO4溶液滴定。试回答:
(1)滴定时所发生反应的化学方程式为
(2)草酸是二元弱酸,则草酸的电离方程式为请从“电离平衡”的角度解释:为什么草酸的第二步电离比第一步难
(3)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)______________________________。
a.托盘天平(带砝码,镊子) b.酸式滴定管 c.碱式滴定管 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒 i.药匙 j.烧瓶
图I表示100mL量筒中液面的位置,A与B,B与C刻度间相差10mL,如果刻度A为30,量筒中液体的体积是___________mL。图II表示25mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________。
| A.是amL | B.是(25-a)mL | C.一定大于amL | D.一定大于(25-a)mL |
(4)实验中,标准液KMnO4溶液应装在_______式滴定管中。若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得的x值会_____(偏大、偏小、无影响)达到滴定终点,溶液由色变为色;
(5)在滴定过程中若用amol·L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为_____________mol·L-1;
(6)若测得x=2,称取某二水合草酸晶体0.1200 g,加适量水完全溶解,然后用0.02000 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为。
硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂。Na2S2O3易溶于水,在酸性溶液中会迅速发生反应。
(1)完成Na2S2O3溶液与稀硫酸混合反应的化学方程式:
H2SO4+Na2S2O3= Na2SO4+H2O++
该反应可用于探究外界条件对反应速率的影响,完成有关的实验设计表(已知各溶液体积均为5mL):
| 实验 编号 |
T/K |
c(Na2S2O3)/mol·L-1 |
c(H2SO4) /mol·L-1 |
实验目的 |
| ① |
298 |
0.1 |
0.1 |
实验①和②探究温度对该反应速率的影响;实验①、③和④探究反应物浓度对该反应速率的影响。 |
| ② |
308 |
|||
| ③ |
0.2 |
|||
| ④ |
0.1 |
(2)Na2S2O3还具有很强的还原性,Na2S2O3溶液与足量氯水反应的化学方程式为______________________。(S元素被氧化为SO42-)
(12)用A、B、C三种装置都可制取溴苯。请仔细分析三套装置,然后回答下列问题。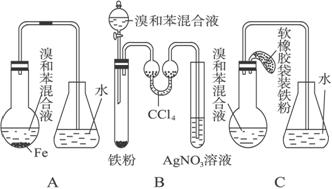
(1)写出三个装置中都发生的化学反应方程式_____________、_____________;写出B的试管中还发生的化学反应方程式_____________。
(2)装置A、C中长导管的作用是________。
(3)B、C装置已连接好,并进行了气密性检验,也装入了合适的药品,接下来要使反应开始,对B应进行的操作是__________,对C应进行的操作是_______________。
(4)A中存在加装药品和及时密封的矛盾,因而在实验中易造成的不良后果是______。
(5)B中采用了双球吸收管,其作用是______________;反应后双球管中可能出现的现象_______________;双球管内液体不能太多,原因是_________________________。
(6)B装置也存在两个明显的缺点使实验效果不好或不能正常进行。这两个缺点是________________________、________________________。
配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为________。
(2)本实验必须用到的玻璃实验仪器除容量瓶、烧杯外,还有____________________________。
(3)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将____________________(填“高于”或“低于”)右边的托盘。假定最终称得小烧杯的质量为____________(填“32.6 g”或“32.61 g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程。
| 砝码质量/g |
50 |
20 |
20 |
10 |
5 |
| 称量(取用砝码)过程 |
(4)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温。
②继续往容量瓶中加蒸馏水至液面接近刻度线1 cm~2 cm。
③将NaOH溶液沿玻璃棒注入500 mL容量瓶中。
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶。
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作按正确顺序编出序号。
(5)某学生实际配制NaOH溶液的浓度为0.48 mol/L,原因可能是( )
A.使用滤纸称量氢氧化钠固体
B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤
D.胶头滴管加水后定容时仰视刻度
按下图装置进行实验:
(1)实验一段时间后,可观察到锥形瓶口上方有白烟生成,请将可能观察到的其他现象补齐:;
有关化学方程式是
(2)由于气温的原因,上述实验一段时间后现象不太明显,需向锥形瓶内加入下列哪种物质才能看到明显现象(填代号)。
| A.氢氧化钠固体 | B.生石灰 | C.浓硫酸 | D.氯化铵固体 |