火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol•L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分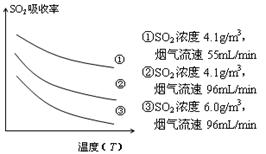
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。
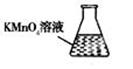

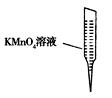
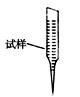
A B C D E
④ 滴定结果如下表所示:
| 滴定次数 |
待测溶液 的体积/mL |
标准溶液的体积 |
|
| 滴定前刻度/mL |
滴定后刻度/mL |
||
| 1 |
25.00 |
1.02 |
21.03 |
| 2 |
25.00 |
2.00 |
21.99 |
| 3 |
25.00 |
2.20 |
20.20 |
则该药品中Na2SO3的质量分数为_________。
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。
活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2=" Fe" +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s)+ 3O2 (g)=2Fe2O3(s)  =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g) =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
(1)写出装置A中发生反应的化学方程式: 。
(2)写出试剂Y的名称: 。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含氯元素的盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和 ;
假设2:存在三种成分:NaHCO3和 、 。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取C中少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
| 步骤2:______________ |
|
| 步骤3:向B试管中滴加过量的稀HNO3溶液,再滴加AgNO3溶液。 |
若溶液变浑浊,结合步骤2中①,则假设1成立,结合步骤2中②,则假设2成立。 |
(4)已知C中有0.1mol Cl2参加反应。若假设l成立,可推知C中反应化学方程式为:
某课外活动小组设计了以下实验验证Ag与浓硝酸反应的过程中可能产生NO,其实验流程图如下:
(1)测定硝酸的物质的量反应结束后,从如图装置B中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为__________________________mol,则Ag与浓硝酸反应过程中生成的NO2在标准状况下的体积为_________________________mL。
(2)测定NO的体积
①从如图所示的装置中,你认为应选用________装置进行Ag与浓硝酸反应实验,选用的理由是_______。
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是______________(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置___________(填“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平。
(3)气体成分分析
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中____________(填“有”或“没有”)NO产生,作此判断的依据是_____________。
我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:
NH3+CO2+H2O+NaCl NaHCO3↓+NH4Cl ;2NaHCO3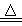 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
回答下列问题:
(1)氨气、二氧化碳与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。
试回答下列有关问题: (Ⅰ)乙装置中的试剂是 ;
(Ⅰ)乙装置中的试剂是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从 管通入 气体,再从 管中通入 气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是 ;
(1)已知Na2S2O3+H2SO4===Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
| 实验编号 |
实验温度/℃ |
c(Na2S2O3)/ (mol·L-1) |
c(H2SO4)/ (mol·L-1) |
| ① |
25 |
0.1 |
0.1 |
| ② |
25 |
0.2 |
0.1 |
| ③ |
25 |
0.1 |
0.2 |
| ④ |
50 |
0.2 |
0.1 |
| ⑤ |
50 |
0.1 |
0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水