下列实验方案合理的是
| A.向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体 |
| B.测定工业烧碱的含量(含杂质碳酸钠)可称取一定量样品放人锥形瓶中,加适量水溶解,再加入稍过量氯化钡溶液,用酚酞作指示剂,用标准浓度的盐酸滴定 |
| C.用分液漏斗分离苯与硝基苯 |
| D.除去氯化铁酸性溶液中的氯化亚铁:加入适量的硝酸溶液 |
常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
| A.混合前的醋酸约1%发生电离 | B.混合后的溶液中 |
| C.氢氧化钠和醋酸和浓度不相等 | D.混合后的溶液呈中性 |
三氟化氮 是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应:
是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生如下反应: 。下列有关该反应的说法正确的是
。下列有关该反应的说法正确的是
A. 是还原剂 是还原剂 |
B. 非极性分子,在潮湿空气中泄漏会看到红棕色气体 非极性分子,在潮湿空气中泄漏会看到红棕色气体 |
| C.每消耗0.2mol氧化剂,可收集到5.418L气体 |
D.若生成1mol  个电子 个电子 |
甲酸为一元弱酸,在15mL0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线。下面有关微粒浓度的大小关系正确的是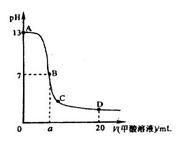
A.在A、B间的任意一点上都存在:


B.在B点:
 ,且a=7.5
,且a=7.5
C.在C点: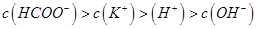
D.在D点: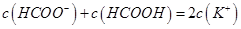
某同学利用下列装置进行浓硫酸和铜反应并验证二氧化硫的性质。按如图实验装置连接仪器和放置药品。加热浓硫酸约1分钟后撤去酒精灯,将铜丝插入液面,反应一段时间后拔出。实验结束后会看到两个试管的液体底部均有少量的白色固体。下列对该实验的现象分析或推断正确的是
| A.湿润的蓝色石蕊试纸先变红后褪色 |
| B.左边试管出现的白色固体是由于浓硫酸的脱水性所致 |
| C.从该实验的描述中可以体会出铜与浓硫酸的反应是一个放热反应 |
| D.本实验体现了二氧化硫的酸性、漂白性和弱氧化性 |
甲装置中所含的是物质的量之比为1:2的 的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是
的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是
A.是该混合溶液中的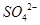 导致了A点溶液的pH值小于B点 导致了A点溶液的pH值小于B点 |
B.AB线段与BC线段在阴极上发生的反应是相同的即: |
| C.BC段阴极产物和阳极产物的体积之比为2:1 |
| D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |