铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
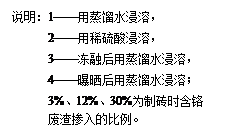
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是 ;
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。
|
|
已知:Cr3+ Cr(OH)3
Cr(OH)3 CrO2-
CrO2-
同温同压下,同体积的N2和SO2分子数之比为 ,物质的量之比为 ,原子总数之比为 ,摩尔质量之比为 ,质量之比为 ,密度之比为 。
取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)原NaOH溶液的物质的量浓度为______________。
(2)曲线A表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________ ,其物质的量之比为________________。
(3)曲线B表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______ mL。
某校研究性小组探究二氧化硫分别与Ba(OH)2溶液、BaCl2溶液反应的实验。
请你参与实验并回答下列问题:
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为___________________;
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为_______________________。
(2)若将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究这种白色沉淀的成分,该小组同学设计了如下实验流程:
则操作①的名称为 ,试剂A的化学式为___________________。
(3)实验表明,当加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是 (填化学式),产生该白色沉淀的离子方程式是______________________。
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 |
|
| ②酸碱中和反应均可表示为:H++OH―===H2O |
|
| ③离子方程式中凡是难溶性酸、碱、盐均要用“↓” |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42―===BaSO4↓”来表示,请写出有关反应的化学方程式(三个):
①_______________________;
②_______________________;
③_______________________。
实验室欲配制500 mL0.2mol/L的NaCl溶液。
(1)通过计算可知,应用托盘天平称量_____________克NaCl固体。
(2)本实验所需要的玻璃仪器除量筒、胶头滴管、烧杯外还有_____________________。
(3)从下面选出所需的操作并写出正确的顺序(填写相应的字母)_________________。
A、洗涤 B、干燥 C、量取 D、称量 E、定容
F、转移溶液 G、稀释 H、溶解
(4)在实验过程中出现如下情况对所配溶液的浓度有何影响(填“偏高”或“偏低”或“无影响”)
①加蒸馏水不慎超过了刻度______________________________。
②容量瓶不干燥,有一定的水分__________________________。
③仰视观察到液面刚好到达刻度线________________________。
(5)用18 mol/L的硫酸配制100mL 1.0mol/L硫酸,实验时应选用的仪器是 (填写编号)。
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10 mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶