按图4-36左装置进行实验,若右图的x轴表示流入电极的电子量,则y轴不可能表示的情况是( )

图4-36
| A.c(Ag+) | B.c( ) ) |
C.溶液的pH | D.银棒质量 |
某链状有机物M由碳、氢、氧三种元素组成,其相对分子质量为74,要使M中氢原子数最少,下列说法正确的是()
| A.一个M的分子中有38个电子 |
| B.M中一定含有醛基和羧基 |
| C.M不存在链状的同分异构体 |
| D.M的结构式为 |
下列化合物:①SO3 ② Fe(OH)3 ③FeCl2 ④CuS ⑤CuI2 ⑥NaHCO3其中不可能通过化合反应制得的是()
| A.①②⑤⑥ | B.③④⑤⑥ | C.④⑤ | D.①②③⑤ |
离子键的强弱主要决定于离子的半径和离子电荷值。一般规律是:离子半径越小,离子电荷值越大,则离子键越强。K2O、MgO、CaO三种物质中离子键由强到弱的顺序是()
| A.K2O、MgO、CaO | B.MgO、K2O、CaO |
| C.MgO、CaO、K2O | D.CaO、MgO、K2O |
已知25℃时,CaSO4在水中沉淀溶解平衡曲线如图所示,向100 mL该条件下的CaSO4饱和溶液中,加入400 mL 0.01 mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是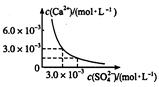
| A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)较原来大 |
| B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小 |
| C.溶液中析出CaSO4固体沉淀,溶液中c(Ca2+)、c(SO42-)都变小 |
| D.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大 |
一定能在下列溶液中大量共存的离子组是
| A.水电离产生的c(H+)=1×10-12mol/L溶液:NH4+、Na+、Cl-、HCO3- |
| B.能使pH试纸变深蓝色的溶液中,Na+、AlO2-、S2-、CO32- |
| C.含有大量Fe3+的溶液,SCN-、I-、K+、Br- |
| D.澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42- |