过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是( )
| A.③②①⑤④ | B.①②③⑤④ | C.②③①④⑤ | D.③⑤②① |
在做焰色反应的实验中,通过蓝色的钴玻璃发现火焰呈现紫色,该物质可能是()
| A.NaCl | B.BaCl2 | C.CuCl2 | D.KCl |
下列物质中属于同分异构体的一组是()
| A.O2和O3 | B.CH4和C2H6 |
| C.CH3OCH3和CH3CH2OH | D.1H和2H |
下列说法正确的是()
| A.32gO2占有的体积约为22.4L |
| B.22.4LN2含阿伏加德罗常数个氮分子 |
| C.在标准状况下,22.4L水的质量约为18g |
| D.22gCO2与标准状况下11.2LHCl所含的分子数相同 |
在反应CuO+H2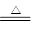 Cu+H2O中,作还原剂的是()
Cu+H2O中,作还原剂的是()
| A.CuO | B.H2 | C.Cu | D.H2O |
下列几种分散系,能产生丁达尔效应的是()
| A.溶液 | B.胶体 | C.悬浊液 | D.乳浊液 |