有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)
(1)能用做干燥二氧化硫气体的装置有________(填代号,下同)
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有________
(3)在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有________
(4)在乙烯与溴水反应制二溴乙烷的实验中,能添加在制乙烯装置和加成反应装置之间,达到控制气流使其平衡目的的是________
(5)若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是________
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是
| A.上下移动①中铜丝可控制生成SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.该反应中浓硫酸体现了强氧化性和脱水性 |
(1)某课外小组设计的实验室制取乙酸乙酯的装置如下图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液。
请回答:
① 乙醇与乙酸制取乙酸乙酯的反应类型是 。
② 若用18O标记乙醇中的氧原子,则CH3CH218OH与乙酸反应的化学方程式是 。
③ 球形干燥管C的作用是 。
④ D中选用饱和碳酸钠溶液的原因是 。
⑤ 反应结束后D中的现象是 。
(2)下列叙述正确的是 (填字母)。
| A.向碘水中加入酒精,萃取碘水中的碘 |
| B.液化石油气、汽油和石蜡的主要成分都是碳氢化合物 |
| C.用淀粉水解液做银镜反应,若有银镜产生,则证明淀粉部分水解 |
| D.将无水乙醇和浓硫酸按体积比1∶3混合,加热至140℃制取乙烯 |
E.为证明溴乙烷中溴元素的存在,可向溴乙烷中加入NaOH溶液,加热;冷却后,加入稀硝酸至溶液呈酸性,滴入AgNO3溶液观察是否有淡黄色沉淀生成
为研究A的组成与结构,某同学进行了如下实验:
| 实 验 步 骤 |
实 验 结 论 |
| (1)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(1)A的实验式为 。 |
| (2)通过质谱法测得其相对分子质量为90。 |
(2)A的分子式为 。 |
| (3)另取9.0 g A,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)A中含有的官能团名称为 。 |
| (4)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2︰2︰1︰1。 |
(4)综上所述,A的结构简式为 。 (5)写出A与NaHCO3反应的化学方程式 。 |
研究NO、NO2、SO2等大气污染气体的处理具有重要意义。
(1)以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+CO (g)  CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4 (s) +4CO (g) CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ)
CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ)
结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式 。
(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:
NO2(g)+SO2(g) SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验
| 实验内容 |
实验现象 |
结论 |
|
| ① |
将充有NO2、SO2气体的密闭烧瓶放入热水中 |
气体红棕色加深,一段时间后颜色不再变化 |
△H 0(填“>”、“<”或“=”) |
② |
在针筒中抽入5mL NO2和5mL SO2气体,封闭针筒前端,充分反应后,将活塞迅速推至5mL处 |
气体红棕色加深并保持不变 |
平衡 (填“向左”、“向右”或“不”)移动 |
③ |
在充有NO2、SO2混合气体的恒容容器中,达平衡后继续通入SO2气体 |
平衡向右移动,SO2的转化率 (填“增大”、“减小”或“不变”) |
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g) N2(g) +CO2(g)。
N2(g) +CO2(g)。
为了提高NO的转化率,下列的措施可行的是
A.再加入一定量的碳 B.增大压强
C.用碱液吸收气体 D.使用催化剂
(4)用间接电化学法除去NO的原理如图所示。已知电解池的阴极室中溶液呈酸性,阴极的电极反应式为 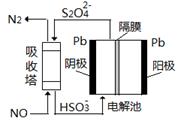
某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验: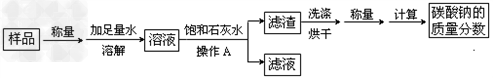
请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有 、 ;
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含 (填溶质的化学式),若有气泡产生,那么测定的样品中碳酸钠的质量分数 (填偏大、偏小、无影响)
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有 (填化学式) ;
滴加盐酸的过程中一定发生反应的离子方程式为 。