下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A.NH4Cl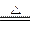 NH3↑+HCl↑ NH3↑+HCl↑ |
| B.NH3+CO2+H2O====NH4HCO3 |
| C.2NaOH+Cl2====NaCl+NaClO+H2O |
| D.2Na2O2+2CO2====2Na2CO3+O2 |
下列各项与反应热的大小无关的是()
| A.反应物的状态 |
| B.生成物的状态 |
| C.反应物的多少 |
| D.表示反应热的单位 |
心脏起搏器中使用的新型电池Li-I2电池使用寿命已超过10年,其反应简化为:2Li+I2══2LiI,下列说法不正确的是()
| A.负极反应:Li-e-══Li+ |
| B.该电池以LiI水溶液为电解质 |
| C.该电池以有机碘化物为电解质 |
| D.Li-I2电池是一种高能长寿的固体电池 |
某制药厂尾气中含少量SO2气体,一般用NaOH溶液或氨水吸收,以防污染环境。分别用0.1 mol·L-1的NaOH溶液或同浓度的氨水处理相同量的尾气,两种方法所需吸收溶液的体积关系是()
| A.NaOH溶液的体积大于氨水 |
| B.NaOH溶液的体积等于氨水 |
| C.NaOH溶液的体积小于氨水 |
| D.无法判断 |
地球大气臭氧层集中在离地面20—30 km以上的平流层,它消耗太阳向地球辐射的紫外线能量的99%。近年来,臭氧不断减少,在两极出现了臭氧空洞,人类皮肤癌、白内障等疾病患者明显增加,海洋生物减少。
这是由于过量紫外线照射()
| A.引起空气发生化学变化 |
| B.产生杀菌消毒作用 |
| C.诱发动植物的基因突变 |
| D.造成病毒感染 |
环境污染已成为人类社会面临的重大威胁,各种污染数不胜数,下列各项中与环境污染无关的是()
①温室效应 ②赤潮 ③酸雨 ④臭氧空洞 ⑤水俣病 ⑥大脖子病 ⑦水华 ⑧潮汐
| A.①② | B.③④ | C.⑤⑥ | D.⑥⑧ |