下图表示一些晶体中的某些结构,它们是氯化钠、氯化铯、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)其中代表金刚石的是____________(填编号字母)。晶体中每个碳原子与____________个碳原子最接近且距离相等。金刚石属于____________晶体。
(2)其中代表石墨的是________。晶体中每个正六边形占有的碳原子数平均为_________个。
(3)其中表示NaCl的是____________。
(4)其中表示CsCl的是____________,CsCl属于____________晶体。
(5)其中表示干冰的是____________,干冰属于____________晶体。晶体中每个CO2分子与____________个CO2分子距离相等,且最接近。
(6)上述五种物质按熔点由高到低的排列顺序为__________________________________。
W、X、y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________ 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为________。将等体积、等浓度的W
的最高价氧化物对应的水化物和Y的氢化物混合,其化学方程式为__________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_____________________________________________________。
(4)W、X、Y、Z四种元素简单离子的离子半径由小到大的顺序是_______________。
某同学用废于电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验:
(1)上述三步操作中都用到的一种玻璃仪器是_____________________________。
(2)将灼烧后的固体移入试管,滴加双氧水,能迅速产生一种使带火星的木条复燃的气体,由此推断黑色固体中含有MnO2,其在反应中的作用为________,写出该反应的化学方程式_______________。MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式_____________________________________。
(3)验证步骤②的滤液中含有NH4+,下面是某一实验方案记录片断。请填写下列空白:
实验操作:_______________________________________________________________。
实验现象:有使湿润的红色石蕊试纸变蓝的气体产生。
实验结论:滤液中有NH4+存在。
I、NaOH、FeCl3是中学化学实验室常用的试剂。
(1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
| A.容量瓶中原有少量蒸馏水 |
| B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中; |
| C.定容时观察液面俯视 |
| D.溶解后未经冷却立即转移至容量瓶内 |
(2)FeCl3可以腐蚀蚀刷电路铜板,反应的离子方程式为________________________________K2FeO4是一种强氧化剂,可作为水处理剂和高容量电池材料。K2FeO4可以由与FeCl3 与KClO在强碱性条件下反应制得,其反应的离子方程式为
______________________________________________.
Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们
的日常生产和生活。
已知:
(1)反应
(2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向_________极(填“正”或“负”);电池的负极反应为_____________________________.
(3)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为________。
(2)在25℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为________。
(3)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断B可能是________。
将碱溶液A、盐溶液B按如下程序进行实验,根据下述现象判断: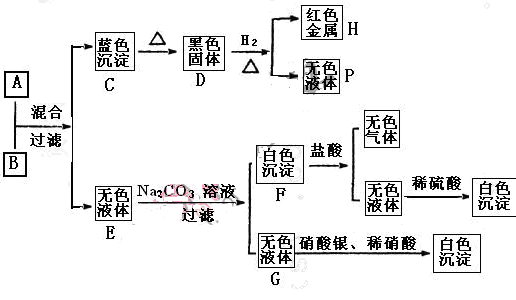
(1)A的化学式B的化学式。
(2)完成下列转化的化学方程式,并用“单线桥法”标明电子转移的方向和数目:
D+H2=H+P:
(3) 写出下列反应的离子方程式:
A+B:
F+盐酸:
(4)盐溶液B中阴离子的检验方法是