已知A元素核外K、L电子层的电子总数与M、N电子层的电子总数相等,B元素的一种单质是自然界中硬度最大的物质。回答下列问题:
(1)A的元素符号为_________,B的元素符号为_________。
(2)在电弧作用下,A的氧化物能与B的单质反应,生成AB2和一种能与人体的血红蛋白结合的气体。写出AB2与水反应生成气体C的化学方程式:_____________________________。
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为;
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应: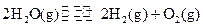
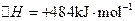 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
(2)已知: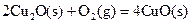 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1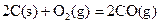 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为。
Cu的化合物在生活及科研中有重要作用,不同反应可制得不同状态的Cu2O
(1)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。
①在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为;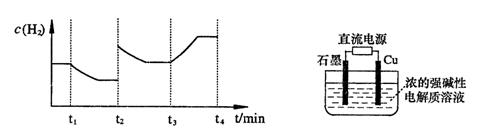
②一定 温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.20 mol水蒸气,发生反应:
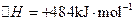 ;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平
;测得20 min时O2的物质的量为0.0016 mol,则前20 min的反应速率v(H2O)= ;该温度下,反应的平衡常数表达式K= ;下图表示在t1时刻达到平衡后,只改变一个条件又达到平衡的不同时段内,H2的浓度随时间变化的情况,则t1时平衡的移动方向为,t2时改变的条件可能为;若以K1、K2、K3分别表示t1时刻起改变条件的三个时间段内的平 衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
衡常数,t3时刻没有加入或减少体系中的任何物质,则K1、K2、K3的关系为;
(2)已知: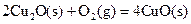 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1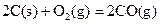 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式;
(3)用电解法也可制备Cu2O。原理如右上图所示,则阳极电极反应可以表示为。
已知:E为常见金属单质,C、D、F、I均为常见气体,其中C、D为单质,F、I为化合物,且组成元素相同,D、F有毒,I为直线型非极性分子,它们有如下框图关系:
(1)反应①阳极的电极反应式。
(2)反应③的化学方程式,
(3)反应④的离子方程式为。
(4)K是一种难溶于水的固体,K受热分解可生成H。实现由G溶液到K的转化时可以加入的试剂是(填写选项字母)
A.NaOH溶液B.氨水 C.Na2CO3溶液D.NaHCO3溶液
(5)将G的饱和溶液加入到沸水中,继续加热可得红褐色液体,写出反应的离子方程式:
该液体接通直流电后___ __极附近颜色加深,这种过程叫做____ _。
(6)若E中含有合金元素,会导致G不纯。测定G的质量分数通常可用碘量法测定:称取mg无水G样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。(杂质不参与反应) 则样品中G的质量分数为: 。
则样品中G的质量分数为: 。
随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。 Ⅰ.MnFe2O4的制备:
Ⅰ.MnFe2O4的制备:


 已知Fe3+、Mn2+沉淀的pH为下表所示。
已知Fe3+、Mn2+沉淀的pH为下表所示。
 (1)此工艺中理论
(1)此工艺中理论 上投入原料Fe(NO3)3和Mn(NO3)2
上投入原料Fe(NO3)3和Mn(NO3)2 的物质的量之比应为。
的物质的量之比应为。 (2)步骤二中b的值为。
(2)步骤二中b的值为。 (3)步骤三中洗涤干净的标准是。
(3)步骤三中洗涤干净的标准是。 Ⅱ.用MnFe2O4热化学循环制氢:
Ⅱ.用MnFe2O4热化学循环制氢: MnFe2O4(s)→MnFe2O(
MnFe2O4(s)→MnFe2O( 4-x)(s) +
4-x)(s) +  O2(g);△H1
O2(g);△H1 MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2
MnFe2O(4-x)(s)+ xH2O →MnFe2O4(s) + xH2(g);△H2 请回答下列问题:
请回答下列问题: (4)若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为
(4)若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+在全部铁元素中的质量分数为 。
。 (5)该热化学循环制氢的优点有(填序号)。
(5)该热化学循环制氢的优点有(填序号)。 A.过程简单、无污染 B.物料可循环使用
A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
C.氧气和氢气在不同步骤生成,安全且易分离 (6)已知 2H2(g)+O2(g)= 2H2O(g);△H3
(6)已知 2H2(g)+O2(g)= 2H2O(g);△H3 则:△H3与△H1、△H2的关系为△H3=。
则:△H3与△H1、△H2的关系为△H3=。
存在于茶叶中的有机物A,其分子中所含的苯环上有2个取代基,取代基不含支链,且苯环上的一氯代物只有2种。A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。它们的转化关系如下: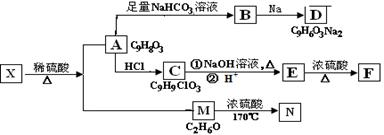
请回答下列问题:
(1) 有机物A中含氧官能团的名称是。
(2) A→B的化学方程式是。
(3)E→F的反应类型是。
(4)1mol A与Br2 反应,最多可消耗Br2 的物质的量是mol。
(5)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的含有苯环的同分异构体有种(不包括R)。
(6)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学
方程式。