硫酸的性质有:
| A.强酸性; | B.吸水性; | C.脱水性; | D.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空: |
(1)实验室干燥氢气___________________;
(2)浓硫酸与金属铜的反应________________;
(3)实际生产中,浓硫酸可用钢瓶贮运_________;
(4)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
[化学—选修3:物质结构与性质]
在元素周期表中,除稀有气体外几乎所有元素都能氢形成氢化物。
(1)氨气属于共价型氢化物,工业常用氨气和醋酸二氨合铜[Cu(NH3)2]Ac的混合液来吸收一氧化碳(醋酸根CH3COO-简写为Ac-)。反应方程式为:[Cu(NH3)2]Ac+CO+NH3═[Cu(NH3)3CO]Ac
①请写出基态Cu+离子的价电子排布式_________________。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为_______________,理由是_________;其中NH3应为_________(填“极性”或“非极性”)分子。
③醋酸分子(CH3COOH)中的两个碳原子的杂化方式分别是_________________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有_________(填序号)。
a.离子键 b.金属键 c.共价键 d.配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如图所示,其中6个Y原子(○)用阿拉伯数字1~6标注.
①已知1、2、3、4号Y原子在晶胞上、下面上.则5、6号Y原子均在晶胞_________(填“侧面”或“内部”)。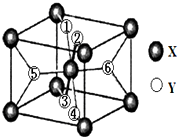
②根据以上信息可以推知,XY2晶体的熔沸点___________(填“>”“=”或“<”)固态氨的熔沸点。
③若该晶胞的边长为anm,密度为ρg/cm3,XY2的摩尔质量为Mg/mol,则阿伏加德罗常数为___________。
[化学—选修2:化学与技术]
煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下: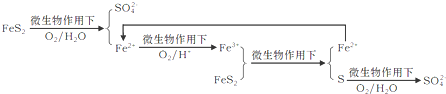
上述过程中Fe2+的作用为________________。写出Fe2+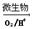 Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g·mol-1)等新型净水剂代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原Cl-和F e3+。
(1)①高铁酸钠主要通过如下反应制取: 2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式_____________。
②Na2FeO4之所以能净水,除它本身具有强氧化性外,另一个原因可能是__________。
(2)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59°C,沸点为11.0°C,易溶于水.ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸(H2C2O4)在60°C时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请回答:
①A中反应产物有K2CO3、ClO2和CO2等,该反应氧化剂与还原剂的物质的量之比为__________。
②A部分还应添加温度控制装置,如水浴加热或酒精灯、温度计;B部分还应补充的装置为___________,理由是________________。
③该装置按②补充完整后,装置A、B、C中还有一处设计明显不合理的是________(填“A”“B”或“C”),请在图中方框中画出该装置改正后的正确的装置图。
④ClO2很不稳定,需要随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行下列实验:准确量取ClO2溶液10mL,稀释成100mL试样;量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定至终点,反应原理:2Na2S2O3+I2→Na2S4O6+2NaI,消耗Na2S2O3溶液V2mL。当_____________时,可以判断此滴定操作到达终点;由以上数据可以计算原ClO2溶液的浓度为________________g/L(用含字母的代数式表示)。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么ClO2、Na2FeO4、Cl2三种消毒剂的消毒效率最小的是__________(填化学式)。
硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、101KPa时:
①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化为SO3(g)的热化学方程式为______________________。
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)⇌2SO3(g).
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为______________________。
②在一容积可变的密闭容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1____________P2(填>、=或<);A、B、C 三点的平衡常数大小关系是______(用KA、KB、KC和>、=、<表示)。理由是____________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为____________。所得溶液中c(H+)-c(OH-)= ______(填序号)。
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3•H2O)-c(H2SO3) D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知:在25℃时NH3•H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为___________________________。
| NH3•H2O |
H2SO3 |
||
| 电离平衡常数为 (mol•L-1) |
1.7×10-5 |
Ka1 |
Ka2 |
| 1.54×10-2 |
1.02×10-7 |
铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)工业上,向炽热铁屑中通入氯化氢可生成无水氯化亚铁,若操作不当,制得的FeCl2会含有少量FeCl3,检验FeCl3常用的试剂是____________________;为防止FeCl2溶液中含有FeCl3,最好在FeCl2溶液中加入___________。
(2)LiFePO4(难溶于水)材料被视为最有前途的锂离子电池材料之一。
①以FePO4(难溶于水)、Li2CO3、单质碳为原料在高温下制备LiFePO4,同时伴随产生一种可燃性气体,该反应的化学方程式为___________。
若有1molC参与反应,则转移的电子数目为___________。
②磷酸铁锂动力电池有几种类型,其中一种(中间是锂离子聚合物的隔膜,它把正极与负极隔开,只允许锂离子通过)工作原理为FePO4+Li LiFePO4,如下图所示。则放电时FePO4一端为电池的_____极,充电时阳极上的电极反应式为__________________。
LiFePO4,如下图所示。则放电时FePO4一端为电池的_____极,充电时阳极上的电极反应式为__________________。
(3)硫化亚铁常用于工业废水的处理。已知:25℃时,溶度积常数Ksp(FeS)=6.3×10-18、Ksp(CdS)=3.6×10-29.请写出用硫化亚铁处理含Cd2+的工业废水的离子方程式__________________,在FeS、CdS的悬浊液中c(Fe2+):c(Cd2+)=______________。
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5mol/L 100mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入___________ml、2mol/L的盐酸(忽略加入盐酸体积)。