下列说法中正确的是( )
| A.原子核外的各个电子层最多容纳的电子数为2n2个 |
| B.原子核外的每个电子层所容纳的电子数都是2n2个 |
| C.原子的最外层有1~2个电子的元素都是金属元素 |
| D.稀有气体元素原子的最外层电子数都是8 |
下列说法中,正确的是
| A.0.1 mol•L-1HCl和0.1 mol•L-1H2SO4与2mol•L-1NaOH溶液反应,其反应速率相同 |
| B.大理石块与大理石粉分别同0.1 mol/L盐酸反应,其反应速率相同 |
| C.Mg、Al在相同条件下分别与0.1 mol/L盐酸反应,其反应速率相同 |
| D.0.1 mol/L HCl和0.1 mol/L HNO3与相同形状和大小的大理石反应,其反应速率相同 |
已知H+(ag)+OH-(ag)=H2O(l) △H= -57.3kJ•mol-1。现有以下四个化学反应方程式:
①H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l);
③HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l);
④CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l);其中反应热为△H=-57.3kJ•mol-1的是
| A.①和③ | B.③ | C.④ | D.以上都不对 |
下列关于热化学反应的描述,正确的是
| A.HCl和NaOH反应的中和热△H= -57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热为△H=+2×283.0kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
下列变化过程,属于放热反应的是
①Ba(OH)2•8H2O 与NH4Cl反应 ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧
| A.②③④⑤ | B.②③④ | C.②⑤ | D.①③⑤ |
(原创)下列说法不正确的是( )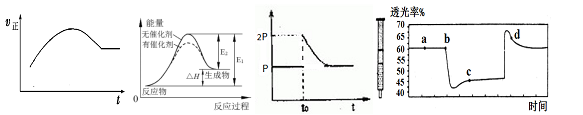
甲乙丙丁
A.绝热恒容密闭容器中通入A和B,发生反应:2A (g)+B (g)  2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 2C(g),图甲为其正反应速率随时间变化的示意图,则该反应为放热反应。 |
| B.催化剂能降低反应的活化能,提高活化分子的百分含量,从而加快化学反应速率。图乙显示的是催化反应与无催化反应过程中的能量关系。 |
C.将BaO2放入密闭真空容器中,反应2BaO2(s) 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 2BaO(s)+O2(g)达到平衡时体系压强为P,保持温度不变,t0时刻将容器体积缩小为原来的1/2,体系重新达到平衡,体系压强变化如图丙所示。 |
D.将一定量的NO2充入针筒中后封口,发生反应2NO2 (g) N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。 N2O4(g),图丁[表示在拉伸和压缩针筒活塞的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。则c点与a点相比,c(NO2)增大,c(N2O4)增大。 |