有X、Y、Z 3种元素,已知X气态氢化物的化学式为H2X,该气态氢化物的式量与X所形成最高价氧化物的式量之比为17∶40,X原子核内质子数与中子数是相同的;Y与X形成离子化合物的化学式为Y2X,Y的阳离子电子层结构与氖相同;Z与X的原子电子层数相同,其气态单质是双原子分子,两原子共用1对电子。
(1)写出各元素的元素符号:X___________,Y___________,Z___________。
(2)X的相对原子质量为___________。
(3)X的离子电子式为___________,X与氢的化合物的电子式为___________。
(4)Y单质在空气中燃烧的化学方程式为______________________。该化合物与水反应的化学方程式为______________________,此反应的离子方程式为______________________。
(5)Z的单质与水反应的化学方程式为_________________________________。
(6)Z2的电子式为___________;Z单质的水溶液与Y2X反应的现象是___________,其化学方程式为(标明电子转移)___________________,此反应的离子方程式为___________________,分析此反应所得到的结论是___________,原因是_____________________。
已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: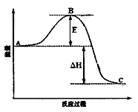
①图中C表示E的大小对该反应的反应热有无影响?。
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?,理由是;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g)△H=―47.2 kJ•mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
物质的分离和提纯的方法有多种,将适合下列各组物质的分离操作或方法的名称填在相应的横线上。
(1)除去Ca(OH)2溶液中悬浮的 CaCO3;
(2)从碘水中提取碘;
(3)用自来水制取蒸馏水;
(4)分离植物油和水;
(共5分)(1)在小烧杯中加入25 mL蒸馏水,加热至________后,向其中加入5滴___________继续煮沸直至溶液呈__________色,即可制得Fe(OH)3胶体。
(2)已知氢氧化铁胶体是氢氧化铁胶粒吸附多余Fe3+生成的。现将氢氧化铁固体粉碎使粒子直径在10-9~10-7m,并悬浮于水中,再向悬浊液中加入___________或______________,即可制得Fe(OH)3胶体。(填两类不同物质)
(1)3.01×1022个OH¯的物质的量为 ;这些OH¯与 molNH3的质量相等,与 g Na+含有的离子数相同。
(2)在标准状况下,2.24LNOx气体的质量为4.6g,则x的值为 。
(3)有四种正盐的混合溶液,含有0.2 mol·L-1 Na+、0.25 mol·L-1 Mg2+、0.4mol·L-1
Cl-,则SO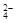 的浓度为
的浓度为
(4)、用14.2g硫酸钠配制成500mL溶液,其物质的量浓度为 mol/L。若从中取出50mL,其物质的量浓度为 mol/L,溶液中含Na+的个数为
若将这50mL溶液用水稀释到100mL, SO42-的物质的量浓度为 mol/L。
(6分)150℃时,只含C、H、O三种元素的有机物A8.8g在一定量的O2中燃烧,生成的混合气体缓慢通过盛有足量无水CuSO4的干燥管,干燥管中的固体增重10.8g,剩余的气体通入盛有足量澄清石灰水的试剂瓶,试剂瓶中的物质增重8.8g,最后的气体缓慢通过盛有灼热CuO的硬质试管,硬质试管中的物质质量减少4.8g。请通过计算和分析回答下列问题:
⑴写有机物的分子式
⑵本题中,A和O2反应的化学方程式为;
⑶若A的结构满足下列条件:能和Na反应但不能和NaOH反应;能进行催化氧化但不能发生消去反应。则A的结构简式为;