有一包白色固体粉末,其中可能含有Ba(NO3)2、CaCl2、K2CO3,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成。
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生;
③取少量②的溶液滴加稀硫酸,有白色沉淀生成;
④另取少量②的溶液滴加AgNO3溶液,有白色沉淀生成。
(1)根据上述实验现象,判断原粉末的组成成分是(写名称)____________。
(2)写出实验步骤①和③中有关反应的方程式:
________________________________________________________________。
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。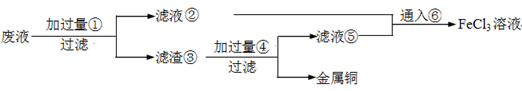
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:。
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe的氧化物和SiO2,实验室以孔雀石为原料制备CuSO4·5H2O及CaCO3,步骤如下: 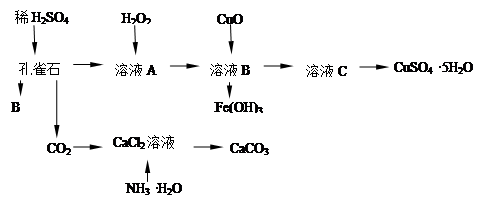
试回答下列问题:
(1)B物质的化学式是在未加入H2O2的溶液中,存在的金属离子有Cu2+、Fe2+、Fe3+。若检验该溶液中Fe3+,选择最合适的试剂是(填代号)。
| A.KMnO4溶液 | B.Fe粉 | C.Na2CO3溶液 | D.KSCN溶液 |
(2)向溶液A加入H2O2的作用是剂(填氧化或还原),离子反应方程式为,选用H2O2而不用Cl2的原因是。
(3)由溶液C获得CuSO4·5H2O,需要经过,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器是。
(4)制备CaCO3时,先通入(填NH3或CO2),若实验过程中有氨气逸出,可选用下列装置中的(填代号)装置吸收氨气。(烧杯中的液体都为水)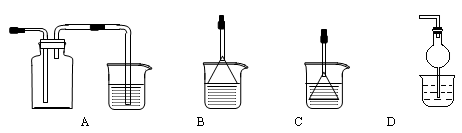
现有含CaO杂质的CaC2试样。某研究性学习小组的同学拟用以下三种方案测定CaC2试样的纯度。请填写下列空白:
(1)第一种方案:请从下图中选用适当的装置,设计一个实验,测定CaC2试样的纯度。
所选用装置的连接顺序为(填各接口的字母):。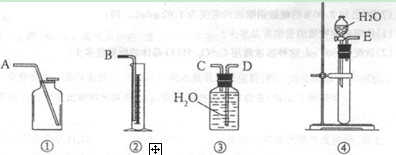
(2)第二种方案:根据试样和水在锥形瓶中反应前后质量的变化,测定CaC2的质量分数。先称取试样1.50g,并称量锥形瓶和水的质量为195.00g,再将试样加入锥形瓶中,反应过程中每隔相同时间测得的数据如下表。
| 读数次数 |
质量/g |
|
| 锥形瓶+水+试样 |
第1次 |
196.30 |
| 第2次 |
196.15 |
|
| 第3次 |
196.05 |
|
| 第4次 |
196.00 |
|
| 第5次 |
196.00 |
①计算CaC2的质量分数时,不必作第6次读数的原因是:。
②此试样中CaC2的质量分数为。(保留2位有效数字)
(3)第三种方案:称取一定质量的试样(1.60g),操作流程如下: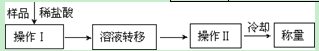
①操作Ⅱ的名称是。
②在转移溶液时,如溶液转移不完全,则CaC2质量分数的测定结果(填“偏大”、“偏小”或“不变”)。
人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
| 过程 |
思路 |
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+ |
①根据氧化还原反应原理,一般物质有还原性,物质有氧化性 |
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色 |
②用离子方程式表示选择H2O2的原因 ③用离子方程式表示溶液变血红色的原因 |
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去 |
④选择铁粉的原因是(用化学方程式表示) ⑤为什么要用煮沸的水 |
| 4.实施实验 |
…… |
| …… |
…… |
(2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。
⑥可能的原因:
⑦改进措施:
硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,商品名称为莫尔盐,是一种复盐。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体。三种盐的溶解度(单位为g/l00gH2O)见下表: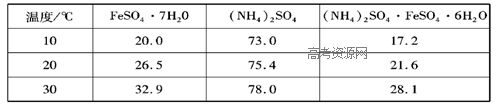
实验用品: Fe屑(含少量碳)、3mol/LH2SO4、( NH4)2SO4、蒸馏水、无水乙醇。
实验步骤流程图: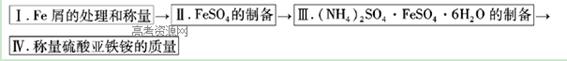
请完成以下实验记录:
(1)步骤I中用10% Na2CO3的热溶液处理铁屑的目的是,经处理后的干燥铁屑质量记为m1;
(2)将称量好的Fe屑放入锥形瓶中,加入适量3mol/LH2SO4溶液,放在水浴中加热至气泡量产生较少时为止(有氢气生成,用明火加热注意安全)。趁热过滤,并用少量热水洗涤锥形瓶及滤纸,将滤液和洗涤液一起转移至蒸发皿中。将滤纸上的固体常温干燥后称重,记为m2;
(3)称取一定质量的(NH4)2SO4,加入______ g(用含m1和m2的代数式表示,要求化简,下同。)水配制成室温下(20℃)的饱和溶液,并将其加入到上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。放置冷却,得到硫酸亚铁铵的晶体,过滤后用____________洗涤晶体。
(4)产品纯度的测定
先称取产品1.600g,加水溶解,配成100ml溶液,移取25.00mL待测溶液与锥形瓶中,再用硫酸酸化的0.0100mol/LKMnO4标准溶液进行滴定其中的Fe2+,达到滴定终点时消耗标准液的平均值为20.00mL,则样品中的(NH4)2SO4·FeSO4·6H2O的质量分数?(列式计算)