现有几种物质的熔点数据如下表:
| A组 |
B组 |
C组 |
D组 |
| 金刚石:3 550℃ |
Li:181℃ |
HF:-83℃ |
NaCl:801℃ |
| 硅晶体:1 410℃ |
Na:98℃ |
HCl:-115℃ |
KCl:776℃ |
| 硼晶体:2 300℃ |
K:64℃ |
HBr:-89℃ |
RbCl:718℃ |
| 二氧化硅1 723℃ |
Rb:39℃ |
HI:-51℃ |
CsCl:645℃ |
据此完成下列问题:
(1)A组属于_______________晶体,其熔化时克服的粒子间的作用力是_______________。
(2)B组晶体共同的物理性质是_______________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于______________________________。
(4)D组晶体可能具有的性质是_______________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为________ g·mol-1。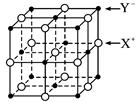
(1)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有双键,核磁共振氢谱表明分子中只有一种类型氢。则分子式为,分子中所有碳原子是否全部在一平面上(填是、否)。
(2)在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子。右边有机物具有光学活性,试用*C标出手性碳原子。若要消除其光学活性,可选用下列哪些化学反应(填字母)a还原、b氧化、c消去、d酯化、e水解。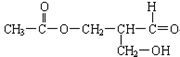
(3)某有机物的结构简式见右,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为;消耗H2、Cu(OH)2、Br2(水)的物质的量之比为 。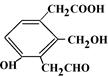
下面的四幅图与所给的四个反应有一一对应关系,请你找出来并填入下面的表格中:
①HCl + NaOH →NaCl + H2O + Q②H2 + Cl2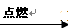 2HCl + Q
2HCl + Q
③CaCO3 → CaO + CO2↑ - Q④Ba(OH)2·8H2O → Ba(OH)2 + 8H2O – Q
| ① |
② |
③ |
④ |
(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:(OCN)2>Cl2>(CN)2>(SCN)2>I2,写出下列反应的方程式
(1)(OCN)2+ KI
(2)AgCN
(3)(SCN)2+ H2O
“西气东输”工程已基本完成,浦东和杨浦大多居民已由管道煤气改用天然气,原管道煤气(水煤气)的主要成分是,现改用天然气则燃具必增加一个阀门,以增加的进量,目的是。
在金属卤化物中,能用于人工降雨的物质是,用于制作照相感光底片的物质是。漂白粉的成份是,有效成分是,搅拌溶于水后,发生反应的化学方程式为。