铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
| A.Fe2(SO4)3 | B.Na2CO3 |
| C.KNO3 | D.FeSO4 |
阿伏加德罗常数用NA表示,下列叙述正确的是
| A.18g D2O含有电子数为10 NA |
| B.NA个Fe(OH)3胶体粒子的质量为107 g |
| C.12g石墨中含有的σ键数目为3NA |
| D.常温常压下,S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2 NA |
下列叙述不正确的是
| A |
B |
C |
D |
 |
 |
  |
 |
| 闪电时会发生反应: N2 + O2  2NO 2NO |
利用丁达尔效应证明烧杯中的分散系是胶体 |
蔗糖中加入浓硫酸搅拌后变黑,因为浓硫酸有吸水性 |
加热时熔化的铝不滴落,证明Al2O3的熔点比Al高 |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4 、H2O2、H2SO4 |
K2SO4 、MnSO4...... |
| ② |
Cl2 、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4-...... |
Cl2 、Mn2+ ...... |
A.第①组反应的其余产物为H2O和 O2
B.第②组反应中Cl2 与 FeBr2的物质的量之比小于或等于1︰2
C.第③组反应中生成1mol Cl2,转移电子2mol
D.氧化性由强到弱顺序为MnO4-> Cl2 > Fe3+ > Br2
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
| A.a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
| B.b和c曲线表示的离子反应是相同的 |
| C.M点时,溶液中沉淀的质量为3.9 g |
| D.原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。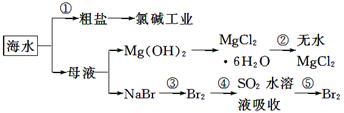
下列有关说法不正确的是
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能量的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |