已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
| A.①② | B.①③ | C.②④ | D.③④ |
类比是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列各种类比推测的说法中正确的是
| A.已知Fe与S能直接化合生成FeS,推测Cu与S可直接化合生成CuS |
| B.已知CaCO3与稀硝酸反应生成CO2,推测CaSO3与稀硝酸反应生成SO2 |
| C.已知Br2与Fe反应生成FeBr3,推测I2与Fe生成FeI3 |
| D.已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应 |
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是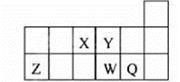
| A.元素Y与元素Z的最高正化合价之和的数值等于9 |
| B.原子半径的大小顺序为:W>Z>Y |
| C.离子半径的大小顺序为:W2->Y2->Z3+ |
| D.W的气态氢化物的热稳定性和还原性均比Q的氢化物的强 |
下列说法正确的是
| A.石油经过分馏及裂化等方法得到的物质均为纯净物 |
| B.用氢氧化钠溶液可以除去乙酸乙酯中混有的乙酸、乙醇杂质 |
C.化合物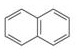 是苯的同系物 是苯的同系物 |
D.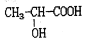 在一定条件下可以发生缩聚反应生成聚合物 在一定条件下可以发生缩聚反应生成聚合物 |
下列离子方程式正确的是
| A.用小苏打类药物治疗胃酸过多:HCO3-+H+==CO2↑+H2O |
| B.FeCl3溶液与Cu的反应:Cu+Fe3+==Cu2++Fe2+ |
| C.向Ba(OH)2溶液中滴加NaHSO4溶液至混合溶液恰好为中性:Ba2++OH-+H++SO42-==BaSO4↓+H2O |
| D.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+==Ca2++H2O+CO2↑ |
下列陈述I、Ⅱ正确并且有因果关系的是
| 选项 |
表述I |
表述II |
| A |
SiO2有导电性 |
SiO2可用于制备光导纤维 |
| B |
SO2有漂白性 |
SO2可使溴水褪色 |
| C |
溶液中含有大量的NO3- |
溶液中不能存在大量I-或S2- |
| D |
将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5min后取烧杯中液体,加碘水变蓝色 |
半透膜有破损 |