一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。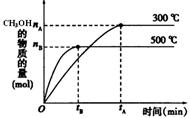
(1)该反应的平衡常数表达式K= ;根据右图,升高温度,K值将 (填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 (用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母)。
a. v生成(CH3OH)= v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d. CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母)。
a.c(H2)减少 b正反应速率加快,逆反应速率减慢
c. CH3OH的物质的量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
;图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。试回答下列问题:
(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用隔开。
(2) Z→L反应的名称是,K的电子式为。
(3) 写出B→F的离子方程式。
(4) 写出K与CO2反应的化学方程式。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式。
.KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过
液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再
用镍板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al、
Si的氧化物含量较高,会导致KOH消耗量偏高,用方程式表示KOH消耗偏高的原因
、。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极:;阳极:。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式
K2MnO4+CO2=KMnO4+MnO2+K2CO3
根据上述反应,从Mn元素的角度考虑KMnO4的产率最高为。与该传统工
艺相比,电解法的优势是、。
(12分).随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如: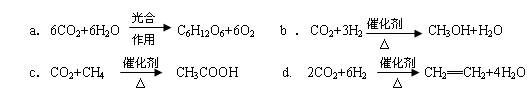
以上反应中,最节能的是,原子利用率最高的是。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min)
②该反应的平衡常数表达式为,升高温度,平衡常数的数值将
(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是.
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下: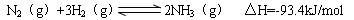
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
图t1时引起平衡移动的条件可能是。
其中表示平衡混合物中NH3含量最高的一段时间是。
②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为。
如图:以一铜锌合金为阳极,一纯铜为阴极(起始时两电极质量相等),进行电解,电解液为硫酸铜溶液,当外电路有1.806×1023个电子转移时,阴极比阳极重19.25g,求铜锌合金中铜的质量分数。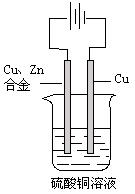
(已知:电极反应式为阳极: Zn-2e-=Zn2+、Cu-2e-=Cu2+
阴极:Cu2+ +2e-="Cu" )
(8分)A、B、C等八种物质有如下框图所示转化关系。又知,A是由地壳中含量最多的金属元素形成的单质,C、D、E是常见的由短周期元素形成的气体单质,气体F与气体G相遇产生大量的白烟,H是厨房中必备一种调味盐(部分反应物和生成物及溶剂水已略去)。
请回答下列问题:
⑴ B的化学式是,F的化学式是。
⑵写出D和E反应的化学方程式:。 ⑶如何检验I中的阳离子
⑶如何检验I中的阳离子