实验室制取SO2的反应原理为:Na2SO3+H2SO4(较浓)====Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率。
(1)这些装置的连接顺序(按气体左右的方向)是_________→_________→_________→
_________→_________→_________→_________→(填各接口的编号)。
(2)实验时甲仪器的作用与原理是
_________________________________________________。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是____________。
(4)Ⅳ处观察到的现象是_____________________________________________。
(5)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为___________。
肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香。实验室制备肉桂酸的化学方程式为: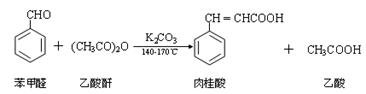
主要试剂及其物理性质
| 名称 |
分子量 |
性状 |
密度g/cm3 |
熔点℃ |
沸点℃ |
溶解度:克/100ml溶剂 |
||
| 水 |
醇 |
醚 |
||||||
| 苯甲醛 |
106 |
无色液体 |
1.06 |
-26 |
178-179 |
0.3 |
互溶 |
互溶 |
| 乙酸酐 |
102 |
无色液体 |
1.082 |
-73 |
138-140 |
12 |
溶 |
不溶 |
| 肉桂酸 |
148 |
无色结晶 |
1.248 |
133-134 |
300 |
0.04 |
24 |
溶 |
密度:常压,25℃测定主要实验步骤和装置如下:
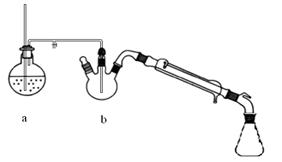
图1制备肉桂酸的反应装置图图2水蒸气蒸馏装置图
Ⅰ合成:按图1连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾。在140~170℃,将此混合物回流45min。
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、减压过滤、洗涤、干燥等操作得到较纯净的肉桂酸;
水蒸气蒸馏:使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率。同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物。回答下列问题:
(1)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥。实验中为控制温度在140~170℃需在中加热(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C. 砂子 D.植物油(沸点230~325℃)
反应刚开始时,会有乙酸酐(有毒)挥发,所以该实验应在中进行操作。
(2)图2中水蒸气蒸馏后产品在(填仪器名称)
(3)趁热过滤的目的,方法:。
(4)加入1:1的盐酸的目的是,析出的肉桂酸晶体通过减压过滤与母液分离。下列说法正确的是。
A.选择减压过滤是因为过滤速度快而且能得到较干燥的晶体
B.放入比布氏漏斗内径小的滤纸后,直接用倾析法转移溶液和沉淀,再迅速开大水龙头抽滤
C.洗涤产物时,先关小水龙头,用冷水缓慢淋洗
D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,再关水龙头
(5)5mL苯甲醛、14mL乙酸酐和7.02g无水碳酸钾充分反应得到肉桂酸实际3.1g,则产率是(保留3位有效数字)。
硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: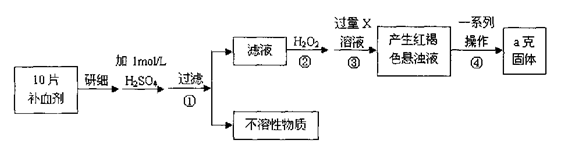 请回答下列问题:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加,该过程的现象为:。
(2)步骤②加入过量H2O2的目的:。
(3)步骤③中反应的离子方程式:。
(4)步骤④中一系列处理的操作步骤:过滤、、灼烧、、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO4—+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需。
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂。来补充铁,则正常人每天服需用含mgFeSO4·7H2O为片剂。
中国石油天然气勘探开发公司位于尼日尔的分支机构CNPC—尼日尔石油公司,日前在该国东部最新发现了2900万桶的石油储量,勘探小组在石油样品中发现一种烃的含氧衍生物。可用下图所示装置确定其分子式和其组成。(不考虑空气进入装置)
回答下列问题:
(1)A中发生反应的化学方程式为。
(2)B装置的作用是,燃烧管C中CuO的作用是。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E连接。现甲、乙两位同学提出了两种连接方案。
方案1 甲同学认为连接顺序是:C→E→D
方案2 乙同学认为连接顺序是:C→D→E
请你评价两种连接方案,判断哪种方案正确并说明理由。
,。
(4)准确称取1.8g烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1∶1,X可能的结构简式为。
实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸的浓度的实验:请完成下列填空:(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、、等。
②称量g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、药匙、。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用(填仪器名称)装配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。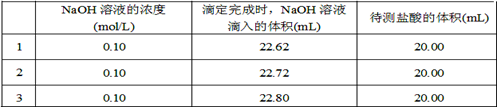
①滴定达到终点的标志是。
②根据上述数据,可计算出该盐酸的浓度约为(保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有。
| A.滴定终点读数时俯视读数 | B.碱式滴定管尖嘴部分有气泡,滴定后消失 |
| C.锥形瓶水洗后未干燥 | D.称量NaOH固体中混有Na2CO3固体 |
E. 酸式滴定管使用前,水洗后未用待测盐酸润洗
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 |
||
| 物质 |
熔点/℃ |
沸点/℃ |
| SiCl4 |
-70 |
57.6 |
| TiCl4 |
-25 |
136.5 |

Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是_____,分离二者所采取的操作名称是__。
(2) ③中反应的化学方程式是____________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2。
(4) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
(5). 某研究性学习小组用图装置模拟“生态马路”清除CO的原理。(夹持装置已略去)若缓慢通入224L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为___ _________。
(6) 当CO气体全部通入后,还要通一会儿空气,其目的是 。