已知具有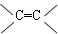 结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2
结构的有机物可被酸性高锰酸钾溶液氧化成二元醇,如:CH2=CH2 HOCH2CH2OH,现以M(
HOCH2CH2OH,现以M( )为原料合成环状化合物F和高分子化合物E和G。
)为原料合成环状化合物F和高分子化合物E和G。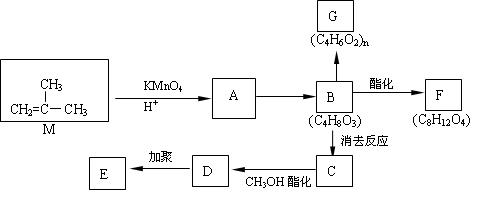
(1)有机物M的名称为 ;C中的官能团名称是 ;
A→B的反应类型是 。
(2)①B→C的化学方程式 。
②B→F的化学方程式 。
③两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为 。
④D→E的化学方程式 。
(3)分子式为C9H10O2的芳香族化合物,属于酯类且只有一个侧连的同分异构体有
种,请写出任意两种的结构简式 。
继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,目前这项研究工作取得了一定进展。其工艺流程如下:
已知:NR3+ HC=NR3 •HCl,且NR3 •HCl易溶于有机溶剂。
(1)有机胺制碱法反应生成小苏打的化学方程式是:;操作①称为;
(2)过程③得到产品的化学方程式是:;
(3)在过程④中,回收有机胺的化学方程式是:;
(4)副产品的用途;
(5)本工艺流程中可循环利用的物质是:。
【化学一一选修5:有机化学基础】
有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应:F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应:M与NaOH溶液反应后的产物,其一氯代物只有一种。
请回答:
(1)B、F的结构简式分别为:、。
(2)反应①~⑦中,属于消去反应的是:(填反应序号)。
(3)D发生银镜反应的化学方程式为:;反应⑦的化学方程式为:。
(4)A的相对分子质量在180—260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为:。
(5)写出符合下列条件F的所有同分异构体的结构简式。
a.能发生银镜反应
b.能与FeCl溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
(15分)CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g)△H= +180.5kJ/mol①
C(s)+O2(g)=CO2(g)△H= -393.5kJ/mol②
2C(s)+O2=2CO(g)△H= -221kJ/mol③
则2NO(g) + 2CO(g) N2(g) + 2CO2(g)△H=。
N2(g) + 2CO2(g)△H=。
(2)-定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K=(用只含a、V的式子表示)。
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:
①有害气体NO的转化率是,0~15minCO2的平均反应速率v(CO2)=____。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是(填序号)。
A.增加CO的量B.加入催化剂
C.降低温度D.扩大容积体积
(4)通过NOx传感器可监测NOx的含量,其工作原理如图所示,
则:
①Pt电极上发生的是反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为。
SiCl4是一种遇水强烈水解,并放出大量的热的化合物。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子)来制备BaCl2·2H2O,工艺流程如下:
已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
②BaCO3的相对分子质量是197; BaCl2.2H2O的相对分子质量是244。
(1)SiCl4发生水解反应的化学方程式。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4蒸汽与NH3反应得到,请写出该反应的化学方程式。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2;②;
(4)生成滤渣A的离子方程式:;
(5)BaCl2滤液经、、过滤、洗涤,再经真空干燥后得到BaCl2.2H2O。
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O_吨。
[化学——选修5有机化学基础]
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基。在一定条件下有如下的转化关系(无机物略去):
(1)属于芳香烃类的A的一种同分异构体(不包括A)中,在同一平面的原子最多有个;
(2)J中所含的含氧官能团的名称为。
(3)E与H反应的化学方程式是;反应类型是。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物M,以M为单体合成的高分子化合物的名称是
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式:
①与FeCl3溶液作用显紫色;
②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种。