下列烷烃的沸点约是CH4:-164 ℃;C2H6:-88.6 ℃;C4H10:-0.5 ℃;C5H12:+36.1 ℃。据此推测C3H8的沸点( )
| A.大约是-40 ℃ | B.低于-88.6 ℃ |
| C.是-164 ℃ | D.高于36.1 ℃ |
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
| B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
下图的各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是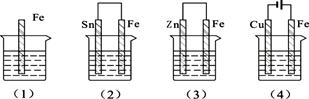
| A.⑷>⑵>⑴>⑶ | B.⑵>⑴>⑶>⑷ |
| C.⑷>⑵>⑶>⑴ | D.⑶>⑵>⑷>⑴ |
在下图装置中,若通电一段时间后乙装置左侧电极质量增加,则下列说法错误的是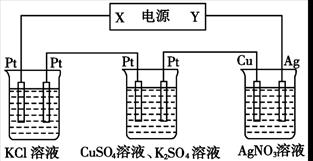
甲乙丙
| A.当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g |
| B.电解过程中装置丙的pH无变化 |
| C.向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 |
| D.乙中左侧电极反应式:Cu2++2e-=Cu |
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图,则下列说法正确的是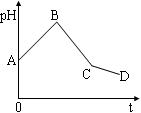
| A.阳极产物一定是Cl2,阴极产物一定是Cu |
| B.BC段表示在阴极上是H+放电产生了H2 |
| C.整个过程中阳极先产生Cl2,后产生O2 |
| D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+,故pH减小 |
如图是一电池,下列有关说法正确的是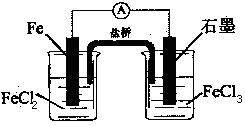
A.该电池负极反应为:2Fe2+-2e-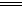 2Fe3+ 2Fe3+ |
| B.当有6.02×1023电子转移时,Fe电极减少56g |
| C.石墨电极上发生氧化反应 |
| D.盐桥中K+移向FeCl3溶液 |