下图中每条折线表示周期表ⅣA—ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是 ( )

| A.H2S | B.HCl | C.PH3 | D.SiH4 |
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g)  CO2 (g)+H2(g)
CO2 (g)+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)(mol) |
H2O(mol) |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为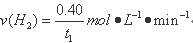 |
| B.反应在t1min时未达平衡, t2min时达到平衡 |
| C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 |
| D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
常温下,下列各组离子在溶液中一定能大量共存的是
A.1.0mol▪L-1的KNO3溶液:H+、Fe2+、Cl-、SO |
| B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
| D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
下列有关化学用语表示正确的是
A.N2的电子式: |
B.邻羟基苯甲酸的结构简式: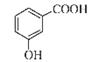 |
C.S2-的结构示意图: |
D.质子数为53,中子数为78的碘原子: |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。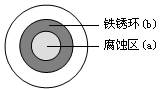
导致该现象的主要原因是液滴之下氧气含量比边缘少。
下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e- Cu2+ Cu2+ |
下列液体均处于25℃,有关叙述正确的是
| A.某物质的溶液pH < 7,则该物质一定是酸或强酸弱碱盐 |
| B.pH= 5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) > c(CH3COO-) |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
| D.pH= 4.5的番茄汁中c(H+)是pH= 6.5的牛奶中c(H+)的100倍 |