将4 L N2和5 L H2充入密闭容器内,进行反应并达到平衡时,混和气体为8.5L,则其中含NH3的体积(气体体积均在相同状况下测定)是( )。
| A.0.25 L | B.0.5 L |
| C.3.3 L | D.4.4 L |
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ/mol、ΔH=-285.8 kJ/mol、ΔH=-890.3 kJ/mol、ΔH=-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+ O2(g)=CO(g)ΔH=-393.5 kJ/mol O2(g)=CO(g)ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g)ΔH=-1 400 kJ/mol |
已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)
ΔH=-57.3 kJ/mol下列结论正确的是( )
| A.碳的燃烧热的数值大于110.5 kJ/mol |
| B.①的反应热ΔH为221 kJ/mol |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1 mol化学键所需的能量(kJ):NN为942、OO为500、NN为154,则断裂1 mol NH键所需的能量(kJ)是( )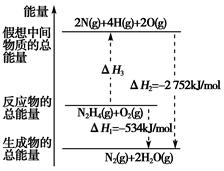
| A.194 | B.391 | C.516 | D.658 |
如图所示,图像表示某一反应过程中的能量变化曲线。下列说法中不正确的是( )
| A.由图可知,该反应为放热反应 |
| B.该反应的焓变为ΔH=-(E2-E1) |
| C.曲线b相对曲线a来说,改变的条件只能是使用了催化剂 |
| D.该反应的发生条件一定是加热 |
下列有关能量的判断或表示方法正确的是( )
| A.由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ·mol-1,可知:石墨比金刚石更稳定 |
| B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 |
| C.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) |
ΔH=-285.8 kJ·mol-1