溶液中某些具有一定氧化性的离子的浓度的测定方法是:取一定体积的溶液,先向其中加入足量的经酸化的KI溶液,I-在酸性条件下被氧化成I2,然后用已知浓度的Na2S2O3溶液进行滴定,发生反应:I2+2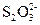 ====2I-+
====2I-+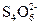 来测定I2的量,从而可以求出氧化性离子的浓度。
来测定I2的量,从而可以求出氧化性离子的浓度。
(1)以上滴定操作需要加入__________(从选项中选择)作为指示剂来判断滴定终点,滴定终点的现象是__________。
| A.酚酞溶液 |
| B.KMnO4酸性溶液 |
| C.淀粉溶液 |
| D.甲基橙溶液 |
(2)已知Cu2+可以与I-发生反应:2Cu2+4I-====2CuI+I2,若取20.00 mL某CuCl2溶液进行上述操作,最后消耗0.11 mol·L-1的Na2S2O3溶液20.00 mL,则CuCl2溶液的物质的量浓度为__________mol·L-1。
(3) 也可以与I-发生如下反应:5I-+
也可以与I-发生如下反应:5I-+ +6H+====3I2+3H2O,某学生取Cu(IO3)2饱和溶液100 mL,加入足量酸化的KI溶液,用0.11 mol·L-1的Na2S2O3溶液进行滴定,消耗了Na2S2O3溶液35.30 mL,有关系式Cu(IO3)2~6.5I2,则Cu(IO3)2溶液的物质的量浓度为__________mol·L-1。
+6H+====3I2+3H2O,某学生取Cu(IO3)2饱和溶液100 mL,加入足量酸化的KI溶液,用0.11 mol·L-1的Na2S2O3溶液进行滴定,消耗了Na2S2O3溶液35.30 mL,有关系式Cu(IO3)2~6.5I2,则Cu(IO3)2溶液的物质的量浓度为__________mol·L-1。
实验室制取乙烯的装置如下图所示,请根据图示回答下列问题: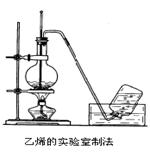
(1)实验室制乙烯的化学方程式为____________________________________
在这个反应中,浓硫酸的作用是____和_____。
(2)某化学课外兴趣小组学生在实验室里制取的乙烯中常混有少量的二氧化硫,老师启发他们并由他们自己设计了下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题:
①I、II、Ⅲ、IV装置可盛放的试剂是IIIⅢIV____(填试剂的序号)。
| A.品红溶液 | B.NaOH溶液 |
| C.浓硫酸 | D.酸性KMnO4溶液 |
②能说明SO2气体存在的现象是_____________________________________________。
③确定含有乙烯的现象是____________________________________________________ 。
应用下列装置,在硬质破璃管中放入还原铁粉和石棉绒的混合物加热,并通过水蒸气,就可以完成“高温下Fe与水蒸气的反应实验”。
请完成该实验中的问题:
(1)写出该反应的化学方程式:_____________;该氧化还原反应的氧化剂是________。
(2)实验前必须对整套装置进行的操作是________。
(3)圆底烧瓶中盛装的是水,该装置受热后的主要作用是____________________;
烧瓶底部放置了几片碎瓷片,碎瓷片的作用是________。
(4)酒精灯和酒精喷灯点燃的顺序是________。
(5)干燥管中盛装的物质是________。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是;装置中B瓶的作用是。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L1;实验后A溶液:V=40mL c(H+)=1.0 mol·L1。假设反应中HNO3既无挥发也无分解,则:参加反应的HNO3的物质的量
为mol。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为。
在下图所示的装置A中,用KMnO4固体和浓盐酸混合制取Cl2,反应的离子方程式为:2MnO4—+10Cl—+16H+=2Mn2++5Cl2↑+8H2O;装置B中的四处棉花依次做了如下处理:①蘸有淀粉—KI溶液 ②蘸有品红溶液③蘸有紫色石蕊溶液④蘸有浓NaOH溶液。(图中夹持装置已略去)。
回答下列问题:
(1)p中盛装试剂的名称为。
(2)反应开始后,观察到的实验现象是:
①处:;②处:;
③处:。
(3)写出④处反应的离子方式:。
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol•L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol•L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol•L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示“步骤二”中溶液变红的原因:、。
(2)甲同学探究“步骤二”中溶液褪色的原因:
实验I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
实验II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
实验III.向2 mL 0.1 mol•L-1 FeCl3溶液中滴加2滴0.1 mol•L-1 KSCN溶液,变红,通入O2,无明显变化。
①实验I的说明;
②实验III的目的是。
得出结论:溶液褪色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制①mol•L-1 的FeCl2溶液,重复“步骤二”中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH,约为3。由此,乙认为红色不褪去的原因可能是②。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
| 步骤 |
试剂及操作 |
现象 |
| i |
③ |
生成白色沉淀 |
| ii |
向i所得溶液中滴加0.1 mol•L-1 FeCl3溶液 |
④ |