某同学在实验室欲配制物质的量浓度均为1.0 mol/L的NaOH溶液和稀H2SO4各450mL。提供的试剂是:NaOH固体和98%的浓H2SO4(密度为1.84 g/cm3)及蒸馏水。
(1)配制两种溶液时都需要的玻璃仪器是____________________________________ 。
(2)应用托盘天平称量NaOH ___________g,应用量筒量取浓H2SO4________mL。
(3)配制时,先要检查容量瓶是否漏水,其方法是
 。
。
(4)浓硫酸溶于水的正确操作方法是_____ ______ _____。
_____。
(5)在配制上述溶液实验中,下列操作引起结果偏低的有_________________
| A.该学生在量取浓硫酸时,俯视刻度线 |
| B.称量固体NaOH时,将砝码和物品的位置颠倒(没有使用游码) |
C.溶解H2SO4操作时没有冷却至室温就立即完成后面的配制操 作。 作。 |
D.在烧杯中溶解 搅拌时,溅出少量溶液 搅拌时,溅出少量溶液 |
E.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
F.将量筒洗涤2—3次,并全部转移至容量瓶中
G.容量瓶中原来存有少量蒸馏水
H.胶头滴管加水定容时俯视刻度
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO在碱性条件下将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定CN-被处理的百分率。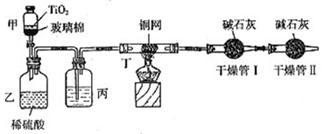
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.2mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出有关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是,丁装置的目的是;干燥管Ⅰ的作用是,干燥管Ⅱ的作用是
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比(填:“偏高”或“偏低”),简述可能的原因:
(4)若干燥管Ⅰ中碱石灰增重1.408g,则该实验中测得CN-被处理的百分率为。
现有ag铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,设计了下图所示的实验装置和实验方案(夹持仪器已省略),请回答相应问题。
(1)未点燃酒精灯前,A、B均无明显现象,其原因是:_____。
(2)点燃酒精灯一段时间后,A、B中可观察到明显的现象。写出碳与浓硫酸加热反应的化学方程式_____________________________________。
(3)待A中不再逸出气体时停止加热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为_____________________(写表达式)。能用该方法测定的前提现象是。
(4)某同学认为上述方法较复杂,使用下图所示的装置和其它常用实验仪器测定某些数据即可。为了快速和准确的计算出铁的质量分数,最简便的实验操作是_______(填写代号)。
A.用排水法测定H2的体积
B.反应结束后,过滤、洗涤、干燥、称量残渣的质量
C.测定反应前后装置和药品的总质量。
某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为_________________________。
(2)这样制取的二氧化硫气体中可能含有的杂质是____________;原因是_______________________________________。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是(用a、b……填写)。
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 |
所盛药品 |
实验现象 |
结论或解释 |
| B |
|||
| C |
CuO固体 |
某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。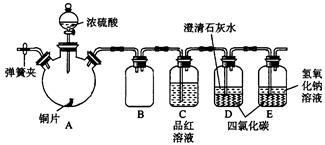
实验选用铜片、98.3%的H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜片一端没入浓H2SO4中,另一端露置在液面上方。
回答下列问题。
(1)Cu与浓H2SO4的反应的化学方程式为____________________。
(2)D、E两容器中CCl4的作用是____________________。
(3)加热过程中,观察到A容器中出现大量白色烟雾,随着反应的进行,A容器下有白色沉淀生成,你认为该沉淀物是_________,分析可能的原因是________________________________________。
(4)对A容器中的浓H2SO4和铜片进行加热,很快发现C容器中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是_________________________________________,设计实验验证你的猜想_______________________________________。
(5)实验结束后,为了减少环境污染,排除各装置中的SO2,可采取的操作是________________________________________________________。
某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①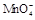 在酸性环境下的还原产物是
在酸性环境下的还原产物是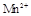 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
 固体 固体 |
  溶液 溶液 |
褪色时间 |
| 1 |
65℃ |
— |
— |
1.0mL |
100s |
| 2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
| 3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
| 4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体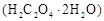 样品
样品 ;配制成
;配制成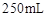 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。