某课外活动小组的同学,研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题:
(1)锌与浓硫酸反应制取二氧化硫的化学方程式为___________ _____ _________。
(2)这样制取的二氧化硫气体中可能含有的杂质是 ____________ ;原因是____ ________________________________ ___。
(3)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是 (用a、b……填写)。
(4)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 |
所盛药品 |
实验现象 |
结论或解释 |
| B |
|
|
|
| C |
CuO固体 |
|
|
用18.4mol·L-1的浓H2SO4配制100mL浓度为1mol·L-1的H2SO4溶液,其操作可分为以下各步:
| A.用量筒取 mL浓H2SO4缓缓注入装有约50mL蒸馏水的烧杯中,并用玻璃棒不断搅拌 |
| B.用约30mL蒸馏水,分成三次洗涤烧杯和玻璃棒,将每次洗液都倒入100mL容量瓶里 |
| C.将稀释后H2SO4溶液小心倒入100mL容量瓶里 |
| D.检查100mL容量瓶口部是否会发生滴漏 |
(E)将蒸馏水直接加入容量瓶,至液面接近环形刻度线 处
(F)盖紧瓶塞,反复颠倒振荡,摇匀溶液
(G)用 向容量瓶里逐滴滴入蒸馏水,至液面最低点恰好和环形刻度线相切
据此填写:(1)上述各步的空白处。
(2)正确的操作顺序是(字母填写) 。
(3)进行A步操作应选择下列量器:①10mL量筒;②50mL量筒;500mL量筒;④1000mL量筒中的(填序号) 。
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用:________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:
(2)球形干燥管C的作用是反应前向D中加入几滴酚酞,反应结束后D中的现象是。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)_________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷B.碱石灰C.无水硫酸钠 D.生石灰
某学习小组用图示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。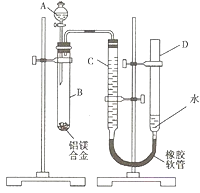
(1)A中试剂为 。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是 。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是 (填序号);记录C的液面位置时,除视线平视外,还应 。
(4)B中发生反应的化学方程式为
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为 。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将 (填“偏大”“偏小”或“不受影响”)。
某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是。
(忽略温度对反应速率的影响)
某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯

| 密度 (g/cm3) |
熔点 (℃) |
沸点 (℃) |
溶解性 |
|
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是_____________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是()
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点