某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表:
| 实验 序号 |
铁的质量/g |
铁的 形态 |
V(H2SO4) /mL |
c(H2SO4) /mol·L-1 |
反应前溶液 的温度/℃ |
金属完全消 失的时间/s |
| 1 |
0.10 |
片状 |
50 |
0.8 |
20 |
200 |
| 2 |
0.10 |
粉状 |
50 |
0.8 |
20 |
25 |
| 3 |
0.10 |
片状 |
50 |
1.0 |
20 |
125 |
| 4 |
0.10 |
片状 |
50 |
1.0 |
35 |
50 |
请分析上表信息,回答下列问题。
(1)实验1、2 表明 对反应速率有影响,其规律是 。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1 盐酸(其他条件不变),发现:放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 。
(忽略温度对反应速率的影响)
用右图所示装置进行中和热测定实验,请回答下列问题: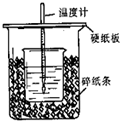
(1)大小烧杯之间填满碎泡沫塑料的作用是,从实验装置上看,图中缺少的一种玻璃仪器是。
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H=,
H2SO4与NaOH反应的热化学方程式为。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”.“不相等”),所求中和热(填“相等”.“不相等”),若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会(填“偏大”、“偏小”、“不受影响”)。
实验室合成乙酸乙酯的步骤如下:
在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙酸、浓硫酸和乙醇外,还应放入碎瓷片,目的是__________________。
(2)反应中加入过量的乙醇,目的是________________________________________________。
(3)如果将上述实验步骤改为在蒸馏烧瓶内先加入乙醇和浓硫酸,然后通过分液漏斗边滴加乙酸,边加热蒸馏。这样操作可以提高酯的产率,其原因是_____________________。
(4)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物,下图是分离操作步骤流程图:
则试剂a是:________,分离方法Ⅰ是:________________________,分离方法Ⅲ是:____________________。
某校学生利用下图所示装置验证氯气与氨气之间的反应(部分装置已略去)。其中A、B分别为氯气和氨气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置A中发生反应的离子方程式为___________________________________。
(2)装置B中浓氨水与NaOH固体混合可制取氨气,其原因是_____________________。
(3)装置C中氯气和氨气相遇,有浓厚的白烟并在容器内壁凝结,同时生成一种常见的气体单质,该反应的化学方程式为_____________________________________。
(4)将装置C中反应生成的固体溶于水,所得溶液中离子浓度由大到小的顺序为___________.
下图是一位学生设计的实验室制取和收集氯气并验证其性质的装置图。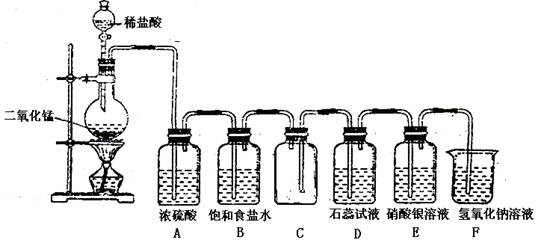
(1)找出在此装置图中出现的错误加以改正。
(2)实验过程中,在D装置中观察到的实验现象是;在E装置中观察到的实验现象是,反应的化学方程式是;
(3) F装置的作用是,反应的离子方程式是。
实验室要配制1.84 mol·L-1的稀硫酸500mL,回答下列问题:
(1)需要98%密度为1.84 g·cm-3的浓硫酸mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②50 mL量筒 ③100 mL量筒 ④1000 mL容量瓶⑤500 mL容量瓶
⑥托盘天平(带砝码) ⑦玻璃棒还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是、。
(4)下列操作的顺序是(用字母表示)。
A. 冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(5)下列操作中,容量瓶所不具备的功能有 (填序号)。
A. 配制一定体积准确浓度的标准溶液 B. 长期贮存溶液
C. 用来加热溶解固体溶质 D. 作为反应容器
(6)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
① 用量筒量取浓硫酸时,仰视读数
② 转移后,没有洗涤烧杯和玻璃棒
③ 定容时,俯视读数
④ 定容时,添加蒸馏水超过刻度线后,吸出多余的溶液